
6.下列金属冶炼的反应原理,错误的是
A.2NaCl(熔融)  2Na+Cl2↑ B.MgO+H2
2Na+Cl2↑ B.MgO+H2 Mg+H2O
Mg+H2O
C.Fe3O4+4CO 3Fe+4CO2 D.2HgO
3Fe+4CO2 D.2HgO 2Hg+O2↑
2Hg+O2↑
5.下列关于盐类水解原理的叙述正确的是
A.一定生成弱酸 B.水的电离平衡不受影响
C.水解过程中要吸收热量 D.溶液的pH一定变大
4.下列物质中,物质的水溶液能导电,且该物质属于非电解质,溶于水时化学键被破坏的是
A.氯化氢 B.蔗糖 C.干冰 D.硫酸钡
3.“垃圾是放错了位置的资源”,应分类回收利用。生活中废弃的塑料制品、旧轮胎、废纸等属于
A.单质 B.有机物 C.氧化物 D.无机物
2.美国和墨西哥研究人员将普通纳米银微粒分散到纳米泡沫碳(碳的第五种单质形态)中,得到不同形状的纳米银微粒,该纳米银微粒能有效杀死艾滋病病毒(HIV-1)。纳米泡沫碳与金刚石的关系是
A.同素异形体 B.同分异构体 C.同系物 D.同位素
1.从石器青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于
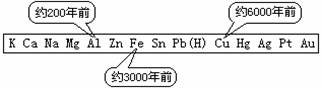
A.金属的化合价高低 B.金属的活动性大小
C.金属的导电性强弱 D.金属在地壳中的含量多少
28.常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶 液体积V(酸)和碱溶液体积V(碱)的关系。
27.将1mL0.010 mol•L-1Pb(NO3)2溶液和2mL0.010 mol•L-1KI溶液混合,是否有PbI2沉淀析出?
26.(10分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A H++HA-,HA-
H++HA-,HA-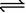 H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)______________________________________________。
(2)若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能是_______0.11mol/L(填“>”、“=”、“<”)。理由是______________________________________________________________________________________________________。
(3)NaHA溶液中各离子浓度由大到小的顺序是______________________。
25. (5分) BiCl3水解生成BiOCl沉淀.
(1)写出水解反应的离子方程式_______________________
(2)医药上把BiOCl叫作次氯酸铋,该名称________(填“合理”或“不合理”),其理由是___________________.
(3)配制BiCl3溶液时,其方法是__________________________.
(4)把适量固体BiCl3置于浓NaCl溶液可得到澄清溶液,其原因是__________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com