
26.(6分)用FeCl3溶液腐蚀敷有铜箔的绝缘板,可制成印刷线路板。发生的反应是:
2FeCl3+ Cu=2FeCl2+CuCl2
现将一块敷有铜箔的绝缘板浸入200mL FeCl3溶液中,一段时间后取出,再加入铁粉A 克(足量),充分反应后滤出固体,经洗涤,干燥后称量,残留固体质量为B 克。再从滤液中取出20.00mL(上述有关反应不考虑溶液体积的变化),滴入0.60mol·L -1AgNO3溶液100mL,恰好将溶液中的氯离子沉淀完。(不写计算过程)
(1)原FeCl3溶液的物质的量浓度是: 。
(2)B的取值范围:(用含A的代数式表示) 。
(3)若A-B = 5.0,则线路板上被腐蚀的铜的质量为:__________ 。
25.(6分)某气态烃完全燃烧生成的二氧化碳和水的物质的量相等,120℃,101Kpa时大气压时,该烃与一定量的氧气混合,点燃后恰好完全反应,产物的密度与反应前相等。求该烃的最简式和分子式(不写计算过程)。
24.(普通班做,8、9、10班不做此题)(8分) A、B、C、D、E、F是常见单质,其中A是用量最大、应用最广泛的金属;D中的元素是地壳中含量最多的金属;D中的元素和E中的元素在周期表中相邻。G、H、I、J、K、L是常见化合物,在常温下G是无色液体,K、L是气体,F、H是黑色固体。以上物质相互间的转化关系如下图所示。
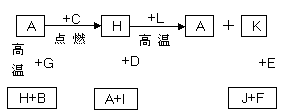
|
|
回答下列问题:
(1)A中的元素在元素周期表中的位置为 周期 族。
(2)K的电子式为 。
(3)写出A与G反应的化学方程式 。
(4)写出K与E反应的化学方程式 。
23.(6分)根据下面的有机物合成路线回答有关问题
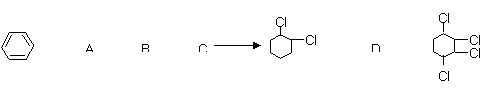
(1)写出C的结构简式:C:
(2)各步反应类型①______②______③______
(3)请写出过程④的反应方程式:
22.(6分)现有常温下的0.1mol·L-1纯碱溶液。
(1)若该溶液中滴加几滴酚酞溶液,溶液呈 色,继续往该溶液中加入过量氯化钙后,溶液呈: 色。
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正
确的是 。
a+)=2c(CO32-) B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1mol·L-1 D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
21.(8分)烷基取代苯 可以被KMnO4的酸性溶液氧化生成 ,
但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得
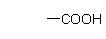 到
,且烷基R上的氢原子在光照的条件下可与氯气发生取代反应。
到
,且烷基R上的氢原子在光照的条件下可与氯气发生取代反应。
现有分子式为C10H14的苯的同系物,回答下列问题:
 (1)若C10H14为一烷基取代苯,写出可以被氧化成为
的同分异构体:
(1)若C10H14为一烷基取代苯,写出可以被氧化成为
的同分异构体:
_______________________________________________________。
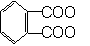 (2)若C10H14为二烷基取代苯,则可以被氧化成为
的同分异构体有________种。
(2)若C10H14为二烷基取代苯,则可以被氧化成为
的同分异构体有________种。
(3)若C10H14与Cl2在光照条件下的一氯代物只有一种,则该苯的同系物的结构简式为_____________。(只要求写出其中一种)
20.(8分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:(1)Cu2O是一种碱性氧化物,, 溶于稀硫酸生成Cu和CuSO4 (2)Cu2O在空气中加热生成CuO (3)2 Fe3+ + Cu = 2 Fe2+ + Cu2+
提出假设
假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
⑴若假设1成立,则实验现象是 。
⑵若滴加 KSCN 试剂后溶液不变红色,能否能证明固体粉末中不含Fe2O3?
⑶若溶液中还有固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 继续滴加几滴新制的氯水后溶液也不变红色,则证明原固体粉末是 。
探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
⑷实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
19. (6分)将含有Ag+、Mg2+、Al3+、Na+等离子的100 mL稀溶液,按下列实验步骤逐一进行分离。填写下列空白(各步可使用的试剂限于在NaOH、CO2、NaCl中选择)
(6分)将含有Ag+、Mg2+、Al3+、Na+等离子的100 mL稀溶液,按下列实验步骤逐一进行分离。填写下列空白(各步可使用的试剂限于在NaOH、CO2、NaCl中选择)
(1)沉淀A是 ,沉淀C是
(2)加入试剂①是 ,②是
(3)滤液D中通入过量的③,发生的有关反应的化学方程式为_____________________________
18.在FeO、Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是
A.10% B.25% C.30% D.35
第II卷(非选择题,共54分)
17.下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
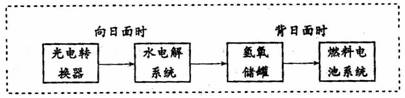 下列有关说法不正确的是
下列有关说法不正确的是
A.该能量转化系统中的水可以循环利用
B.燃料电池系统产生的能量实际上来自于水
C.燃料电池工作一段时间后,溶液的pH下降
D.燃料电池放电时的正极反应:O2 + 4e- + 2H2O=4OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com