
19.盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为 。
某同学未加入氧化剂,而是将它设计成一个电解装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:

请写出电极反应式 ;
请写出总反应的化学方程式
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积 (填大于、等于或小于)100mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗? (填“可行”或“不可行”)。
(3)将等质量的铜片分别与等体积、过量的浓硝酸和过量的稀硝酸反应,所得到的溶液前者呈绿色, 后者呈蓝色, 某同学提出可能是 Cu2+ 浓度不同引起的,
你同意这种看法吗? (填“同意”或“不同意”),
原因是 。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论: 。
18.“氢能”将是未来最理想的新能源。
I、实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。(填序号)
A.2H2(g)+O2(g)
 2H2O(l) △H= -142.9kJ·mol-1
2H2O(l) △H= -142.9kJ·mol-1
B.H2(g)+1/2
O2(g)  H2O(l) △H= -285.8kJ·mol-1
H2O(l) △H= -285.8kJ·mol-1
C.2H2+O2 2H2O(l) △H= -571.6kJ·mol-1
2H2O(l) △H= -571.6kJ·mol-1
D.H2(g)+1/2
O2(g)  H2O(g) △H= -285.8kJ·mol-1
H2O(g) △H= -285.8kJ·mol-1
II、某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+_____ ______________ ④2HgO
______________ ④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:
____________________________________________________________________________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:_______________________________________。
III、利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)

完成下列反应的化学方程式:反应①________________________________________________;
反应②_____________________________________________________________________。
此法制取氢气的最大优点是_______________________________________________。
IV、氢气通常用生产水煤气的方法制得。其中CO(g)+
H2O(g) 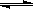 CO2(g)+
H2(g); △H<0。在850℃时,K=1。
CO2(g)+
H2(g); △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________________________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大于”、“小于”或“等于”)。
V、氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 克;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式
17.2006年11月23日中科院网报道,核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:
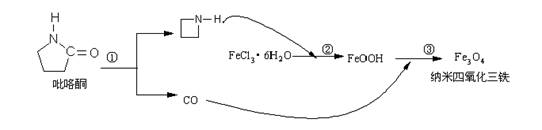
下列有关叙述不合理的是:
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
C.在反应②环丙胺的作用可能是促进氯化铁水解
D.反应③的化学方程式是:6FeOOH +CO = 2Fe3O4 +3H2O + CO2
第Ⅱ卷(非选择题 共49分)
16.漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2 = 4 ClO2↑+ H+ +Cl-+2H2O。( HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应反应缓慢,随后反应迅速,其原因是
A、在酸性条件下,亚氯酸钠的氧化性增强 B、溶液中的H+起催化作用
C、ClO2逸出,使反应的生成物浓度降低 D、溶液中的Cl-起催化作用
15.向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)
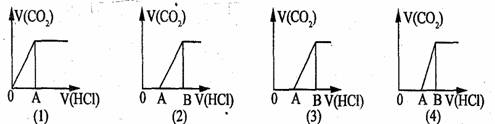
A.M中只有一种溶质的有(1)和(3) B.M中有两种溶质的有(2)和(4)
C.(2)图显示M中c(NaHCO3)>c(Na2CO3) D.(4)图显示M中c(NaHCO3)>c(Na2CO3)
14.设NA表示阿伏加德罗常数,下列说法错误的是
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3溶液中含有NA个Fe3+
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
13.2009年11月末,中国海南省出入境检验检疫局检验结果和海口市卫生防疫站复检证实,统一蜜桃多汁、农夫山泉等三款饮料砷成分(俗称“砒霜”) 均超标,被指不能食用。相关厂家陷入“砒霜门”。砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用一定剂量的氧化剂解毒。下列有关叙述正确的是
A.砷原子最外层有3个电子
B.砷化氢(AsH3)比NH3稳定
C.砷酸(H3AsO4)的酸性强于磷酸
D.砷的+3价化合物的毒性强于+5价化合物
12.在密闭容器中充入4 mol X,一定温度下发生反应:4X(g) 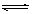 3Y(g) +Z(g)。达到平衡时,有30%的X发生分解,则平衡时混合气体总物质的量是
3Y(g) +Z(g)。达到平衡时,有30%的X发生分解,则平衡时混合气体总物质的量是
A.4 mol B.3.4 mol C.2.8 mol D.1.2 mol
11.2006年1月,我国研制出能在超低温状态下工作的镍氢电池。氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是:
H2+2NiO(OH) 放电充电2Ni (OH)2 , 根据此反应判断,下列叙述中正确的是
A.电池放电时 ,电池负极周围溶液的pH不断增大 B.电池充电时, 镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,H2是正极
10.在25℃,101Kpa下由HCHO(g)、H2和CO组成的混合气体共6.72g,其相对氢气的密度为14,将该气体与2.24L氧气(标准状况)充分反应后的产物通过足量的Na202粉末,使Na202粉末增重的质量为
A.等于6.72g B.小于6.72g C.大于6.72g D.无法计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com