
第二节 听取信息(共5小题;每小题1分,满分5分)
听下面一段对话,请根据题目要求,从所听到的内容中获取必要的信息,填入答题卡标号为16-20的空格中。听录音前,你将有10秒钟的阅题时间,录音读两遍。你将有80秒钟的作答时间。
|
ORDER FORM |
|
Customer
details: Name: Mr. Saunders Company: 16._____________ Company Address: 17.________, Hong Kong Telephone: 3357218 Fax: 18._________ |
|
Order
details: Items: 19.________ Quantity /Amount: 10 Total charge(including transportation): 20.________ |
36.(20分)如图所示,空间存在着强度为E=2.5×102N/C、方向竖直向上的匀强电场,一长为L=0.5m的绝缘细线,一端固定在O点,一端拴着质量m=0.5kg、 电荷量q= 4×10-2C的小球。现将细线拉直到水平位置,使小球由静止释放,则小球能运动到最高点.不计阻力。取g=10m/s2.求:
(1)小球的电性。
 (2)细线在最高点受到的拉力。
(2)细线在最高点受到的拉力。
(3)若小球刚好运动到最高点时细线断裂,
则细线断裂后小球继续运动到与O点水平方向
距离为细线的长度L时,小球距O点的高度.
广东省增城中学2010届高三第四次综合测试
35.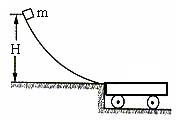 ( 16分)如图所示,光滑曲面轨道的水平出口跟停在光滑水平面上的平板小车上表面相平,质量为m的小滑块从光滑轨道上某处由静止开始滑下并滑上小车,使得小车在光滑水平面上滑动。已知小滑块从高为H的位置由静止开始滑下,最终停到小车上。若小车的质量为M。g表示重力加速度,求:
( 16分)如图所示,光滑曲面轨道的水平出口跟停在光滑水平面上的平板小车上表面相平,质量为m的小滑块从光滑轨道上某处由静止开始滑下并滑上小车,使得小车在光滑水平面上滑动。已知小滑块从高为H的位置由静止开始滑下,最终停到小车上。若小车的质量为M。g表示重力加速度,求:
(1)滑块到达轨道底端时的速度大小v0
(2)滑块滑上小车后,小车达到的最大速度v
(3)该过程系统产生的内能Q
(4)若滑块和车之间的动摩擦因数为μ,则车的长度至少为多少?
34.Ⅰ(8分)
①某同学探究恒力做功和物体动能变化间的关系,方案如图所示.他想用钩码的重力表示小车受到的合外力,为减小这种做法带来的误差,实验中要采取的两项措施是:
a
b _
②如图所示是某次实验中得到的一条纸带,其中A、B、C、D、E、F是计数点,相邻计数点间的时间间隔为T。距离如图。则打B点时的速度为 ;要验证合外力的功与动能变化间的关系,测得位移和速度后,还要测出的物理量有
;要验证合外力的功与动能变化间的关系,测得位移和速度后,还要测出的物理量有

Ⅱ .(本题10分)标有“6V,1.5W”的小灯泡,测量其0-6V各不同电压下的实际功率,提供的器材除导线和开关外,还有:
 A.直流电源 6V(内阻不计)
A.直流电源 6V(内阻不计)
B.直流电流表0-3A(内阻0.1Ω以下)
C.直流电流表0-300mA(内阻约为5Ω)
D.直流电压表0-15V(内阻约为15kΩ)
E.滑动变阻器10Ω , 2A
F.滑动变阻器1kΩ , 0.5A
(1)实验中电流表应选用 ,滑动变阻器应选用 。(序号表示)
(2)在虚线方框图中画出电路图
以下为计算题(共2小题)
33.(16分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。
2CO2+N2。
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)(mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)(mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验 编号 |
T(℃) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
|
|
|
124 |
|
Ⅲ |
350 |
|
|
124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。

|

32.(16分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
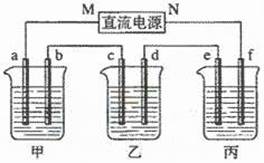
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
① 电源的N端为 极;
② 电极b上发生的电极反应为 ;
③ 列式计算电极b上生成的气体在标准状况下的体积: ;
④ 电极c的质量变化是 g;
⑤ 电解前后个溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
。
31.(16分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是
。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用 。
(3)Ⅲ中,生成FeCO3的离子方程式是 。
若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42的操作是:
。
(5)已知煅烧FeC03的化学方程式是4FeCO3+O2
 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量
是 Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com