
6.已知 ,
, 是非零向量,且
是非零向量,且 ,
, 的夹角为
的夹角为 ,若向量
,若向量 ,则
,则 ▲ .
▲ .
5.已知函数 ,若在区间
,若在区间 上随机取一点
上随机取一点 ,则使得
,则使得 的概率为 ▲ .
的概率为 ▲ .
4.某工厂对一批产品进行抽样检测,根据抽样检测后的产品净重(单位:克)数据绘制的频率分布直方图如图所示,已知产品净重的范围是[96,106],若样本中净重在 的产品个数是24,则样本中净重在
的产品个数是24,则样本中净重在 的产品个数是 ▲ .
的产品个数是 ▲ .
3.运行如图的算法,则输出的结果是 ▲ .


2.复数 (
( 为虚数单位)的实部是 ▲
.
为虚数单位)的实部是 ▲
.
1.已知集合 ,
, ,则
,则 ▲ .
▲ .
7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL 5%KSCN溶液和2.5
mLpH=4的 HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度。
(2)制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,
加入2 mL蒸馏水溶解,再加入2 mL 1∶1 HNO3溶液,小心加热2-3min。冷却
后,全部移入100 mL容量瓶中,再加入4.0 mL 5%KSCN溶液和10.0 mL pH=4
的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL。取25.00 mL
待测液加入与(1)相同规格的比色管中。
(3)比色:将(2)所得比色管中的溶液与(1)各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围。
请回答下列问题:
(1)在含有Fe3+的溶液中加入K SCN溶液,溶液显 色。
SCN溶液,溶液显 色。
(2)完成该实验,还缺少的仪器有 、 。
(3)加入pH=4的 HAc-NaAc缓冲溶液的目的是 。
(4)实验中量取 HNO3溶液、HAc-NaAc缓冲溶液量筒即可,原因是 。
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是 。
(6)若测得待测液中Fe3+的物质的量浓度为cmol/L,药片的质量为m,则药片中铁元素的质量分数为 。
江苏省苏北四市2010届高三上学期期末联考
20.选做题:本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,每题12分。请选择其中一题作答,并把所选题目对应字母后的方框涂黑。若两题都作答,将按A题评分。
A.“物质结构与性质”
下表为长式周期表的一部分,其中的字母代表相应的元素。
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b |
c |
d |
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
f |
|
g |
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
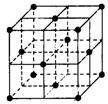 试回答下列问题:
试回答下列问题:
(1)元素h的二价阳离子的基态电子排布式为 。
(2)在1185 K时,元素h可形成如图所示基本结构单元的晶体,
则其中h原子的配位数 是
。
是
。
(3)c、d、e、f元素的第一电离能(I1)由小到大的顺序
为 。(用相应元素符号表示)
(4)表中所列的元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是 。邻甲基苯甲醛分子中碳原子轨道的杂化类型为 。1 mol 苯甲醛分子中σ键为 mol。
(5)一种由表中元素形成的离子与单质d3互为等电子体,其化学式为 。
B.“实验化学”
为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了 以下实验研究。
以下实验研究。
[实验原理]有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量。
[实验用品]2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5% KSCN溶液、pH=4的HAc-NaAc缓冲溶液、1∶1 HNO3溶液、复方硫酸亚铁药片。
铁架台(铁夹)、100 mL容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉
网、酒精灯、玻璃棒、25 mL比色管、pH试纸。
[实验过程]
(1)配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、
19.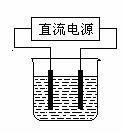 (10分)以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(10分)以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)电解饱和食盐水的化学方程式为 。
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置
进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到
标准状况下氢气2.24 L。(设电解前后溶液的体积均为1 L,
不考虑水的蒸发或气体的溶解)
①理论上,电解后溶液的pH= 。
②若实际测得反应后溶液的pH=13.00,则造成这种误差的原因可能是:
a.氯气和氢氧化钠溶液反应
b.还可能为(用化学方程式表示): 。
若是原因b,则电解过程中溶液减小的质量是 。
(3)若溶液实际减少的质量为4.23 g,则所产生的气体的物质的量之比是多少?
(写出计算过程)
18. (12分)高分子材料M在光聚合物和金属涂料方面有重要用途。
(12分)高分子材料M在光聚合物和金属涂料方面有重要用途。
|

 M可以用丙烯为原料,通过如下图所示的路线合成:
M可以用丙烯为原料,通过如下图所示的路线合成:
回答下列问题:
(1)写出E中两种官能团名称 和 。
(2)C→甲基丙烯酸的反应类型为 。
(3)符合下列条件的甲基丙烯酸的链状同分异构体数目为 (含甲基丙烯酸)。
①能与溴水反应褪色;②与Na2CO3溶液反应放出CO2气体
(4)A→B的反应中还可能生成一种有机副 产物,该副产物的结构简式为
。
产物,该副产物的结构简式为
。
(5)请用反应流程图表示A→丙烯酸的合成线路,并注明反应条件
(提示:氧化羟基的条件足以氧化C=C)。
例:由乙醇合成聚乙烯的反应流程图可表示为:

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com