
20.(4分)对于弱酸在一定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系。若在25℃时有HA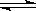 H++A-,则K=C(H+)•C(A-)/ C(HA),式中K为电离平衡常数,只与温度有关,各粒子的浓度为达到平衡时的浓度。下表是几种常见弱酸的电离平衡常数(25℃)
H++A-,则K=C(H+)•C(A-)/ C(HA),式中K为电离平衡常数,只与温度有关,各粒子的浓度为达到平衡时的浓度。下表是几种常见弱酸的电离平衡常数(25℃)
|
酸 |
电离方程式 |
电离平衡常数 |
|
CH3COOH |
CH3COOH
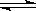 CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3 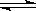 HCO3-+ H+ HCO3-+ H+HCO3- 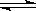 CO32-+ H+ CO32-+ H+ |
K1=4.31×10-7 K2=5.61×10-11 |
|
H2S |
H2S 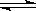 HS-+ H+ HS-+ H+HS- 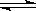 S2-+ H+ S2-+ H+ |
K1=9.1×10-8 K2=1.1×10-12 |
|
H3PO4 |
H3PO4 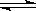 H2PO4- + H+ H2PO4- + H+H2PO4- 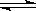 HPO42-+ H+ HPO42-+ H+HPO42- 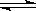 PO43-+ H+ PO43-+ H+ |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
回答下列问题:
(1)K只与温度有关,当温度升高时,K值 (填“增大”、“减小”或“不变”)
(2)在温度相同时,各弱酸K值不同,那么K值的大小与酸性相对强弱的关系是
(3)若把CH3COOH、 H2CO3 、HCO3-、H2S、 HS-、H3PO4 、H2PO4-、HPO42-都看作是酸,其中酸性最强的是 ,最弱的是
(4)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时Cmol/L的CH3COOH的电离度为α(当若电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子占原来总分子数的百分数叫做该电解质的电离度)。试表示该温度下醋酸的电离平衡常数K=
19.(4分)将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:_________________________________________________________。
问题2:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:________ ____ ___。
18.(9分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用图4装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
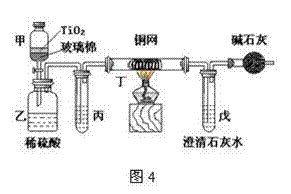
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
⑴甲中反应的离子方程式为 ,
乙中反应的离子方程式为 。
⑵乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是 ,丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
⑶戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因 。请提出一个能提高准确度的建议(要有可操作性,且操作简单) 。
17.(9分)有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
①X与Z、Y与W分别同族;
②X、Z、W分别与Y都可组成两种中学常见化合物;
③Y的阴离子与Z的阳离子的核外电子排布相同;
④这4种元素的单质中有一种易溶于CS2溶济。
(1)写出由Y与Z两元素形成化合物Z2Y2的电子式 ,其化学键类型是 。
(2)写出2种均由这4种元素所组成的化合物在水溶液中发生反应的离子方程式 。
16.若某共价化合物分子中只含有C、N、H三种元素,且以n(C)、n(N)分别表示C、N的原子数目,则H原子数目最多等于 ( )
A 2n(C)+2+n(N) B 2n(C)+2+2n(N)
C 3n(C)+2 D 2n(C)+2n(N)+1
第Ⅱ卷(非选择题 共66分)
15.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
A.AgNO3 [Ag2O] B.NaOH [NaOH] C.NaCl [盐酸] D.CuSO4 [Cu(OH)2]
14.今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是 ( )
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,
酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出
a=b=0.1 mol/L
13.某密闭密闭容器中进行如下反应:X(g)+2Y(g)
 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
A.1< <3
B.
<3
B. <
< <
< C.3<
C.3< <4 D.
<4 D. <
< <
<
12.某元素X的核外电子数等于核内中子数.取该元素单质2.8g与氧气充分作用,可得到6g化合物XO2.该元素在周期表中的位置是 ( )
A.第三周期 B.第二周期 C.第Ⅳ主族 D.第Ⅴ主族
11. 2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮, 这种高聚氮的N-N键的键能为160kJ/mol(N2分子中的键能为942kJ/mol),晶体结构如图3所示。下列有关高聚氮的说法不正确的是
2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮, 这种高聚氮的N-N键的键能为160kJ/mol(N2分子中的键能为942kJ/mol),晶体结构如图3所示。下列有关高聚氮的说法不正确的是
A.高聚氮晶体属于分子晶体
B.高聚氮晶体中每个N原子和另外3个N原子相连
C.高聚氮可能成为炸药
D.高聚氮转变成氮气是氧化还原反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com