
24.(普通班做)(6分)在100mL 0.6mol·L-1 AlCl3溶液中,滴加一定量的1.0mol·L-1 NaOH溶液,充分反应后得到3.9g白色沉淀,试计算加入NaOH溶液的体积为多少?
23.(8分)将6g纯铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中充分反应后得到200mL0.5mol/L的FeSO4溶液和5.2g固体,求:
(1)反应后生成铜多少克? (2)加入铁粉前Fe2(SO4)3物质的量浓度。
22.(8分)A-J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A为常见的金属单质,B是一种红棕色固体,C是一种高熔点物质,通常可用做耐火材料。

请回答下列问题:
(1)G→J的化学方程式为___________________________________。
(2)A+B→C+E的化学方程式为______________________________。
(3)C物质与氢氧化钠反应的离子方程式为___________________________________。
(4)H与I混合会产生白色沉淀,该反应的离子方程式为______________________。
21.(6分) 工业上用铝土矿(主要成分是Al2O3以及少量Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料。提取的操作过程可以用以下流程图表示:

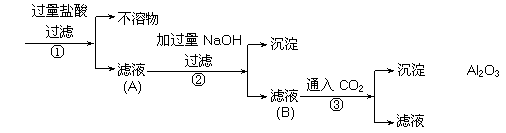
(1)写出滤液A中一种溶质与过量NaOH溶液反应进入滤液B中的离子方程式
__________________________________________________________________;
(2)若步骤①中没有过滤操作而直接进入步骤②,对后面操作将产生的影响是__________________________________________________________________。
(3)实际操作过程中,步骤③中的CO2是过量的,试写出步骤③的离子方程式:
__________________________________________________________________。
20.(9分)某研究小组为了探究“铁与水蒸气”能否发生反应及反应产物,进行了系列实验。
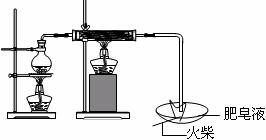 (1)用右图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
(1)用右图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂当
时(填实验现象),说明“铁与水蒸气”能够进行反应。写出铁与水蒸气反应的化学方程式 。
(2)为了研究一定时间内铁粉的转化率(铁粉的转化率:已经反应的铁的质量与原来铁的总质量之比),他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率。
 ①收集并测量气体体积应选右图中的 装置
①收集并测量气体体积应选右图中的 装置
②称取0.28g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088g/L,最好选用 规格的量筒 (选填字母序号)
A.100ml B.200ml C.500ml D.1000ml
③收集的气体体积为V升(已换算成标准状态),铁粉的转化率为 。
(3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤。向滤液中滴加KSCN溶液,观察溶液的颜色。在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满)。
|
|
现象 |
结论与解释 |
|
可能① |
|
|
|
可能② |
|
|
19.(9分)某学生设计了如下的实验装置图用于制备干燥纯净的氯气。

(1)指出上述装置图中的错误(有几处答几处)
①____________________________________ ②铁圈上少石棉网
③ __________________________________ ④ _________________________________
⑤ __________________________________ ⑥ _________________________________
(2)改正后的装置图中,洗气瓶中的饱和食盐水、浓硫酸以及氢氧化钠溶液各起什么作用?
①饱和食盐水的作用 _________________________________;
②浓硫酸的作用 _____________________________________;
③氢氧化钠溶液的作用 _______________________________。
(3)写出改正后D装置中发生反应的离子方程式:___________________。
18. 用稀H2SO4、NaOH和A1为原料制取A1(OH)3,甲、乙、丙三同学分别用三种不同途径制备:
甲:Al Al2(SO4)3
Al2(SO4)3 Al(OH)3
Al(OH)3
乙:Al NaAlO2
NaAlO2 Al(OH)3
Al(OH)3
 Al
Al Al2(SO4)3
Al2(SO4)3
丙: Al(OH)3
Al NaAlO2
NaAlO2
若要制得等量Al(OH)3,则( )
A.乙消耗原料最少 B.三者消耗原料相同
C.丙消耗原料最少 D.甲、乙消耗原料相同
第Ⅱ卷(非选择题,共46分)
17. 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加的NaOH溶液的体积关系如图所示:
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加的NaOH溶液的体积关系如图所示:
则溶液中c(Cl-)与c(SO )之比为( )
)之比为( )
A.1︰1 B.2︰3 C.3︰2 D.2︰1
16.下列各反应的离子方程式中,有错误的是( )
 A.氢氧化铝与盐酸反应:Al(OH)3+3H+ Al3++3H2O
A.氢氧化铝与盐酸反应:Al(OH)3+3H+ Al3++3H2O
 B.在碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3- +OH- CaCO3↓+H2O
B.在碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3- +OH- CaCO3↓+H2O
 C.碘化钾溶液中滴入溴水:2I-+Br2 I2+2Br-
C.碘化钾溶液中滴入溴水:2I-+Br2 I2+2Br-
 D.氢氧化铝溶于氢氧化钠溶液:Al(OH)3+3OH- AlO2-+3H2O
D.氢氧化铝溶于氢氧化钠溶液:Al(OH)3+3OH- AlO2-+3H2O
15.下列各组离子,因产生沉淀而不能大量共存的是( )
A.Cu2+ 、 Na+ 、 Cl- 、 SO42- B.H+ 、 HCO3- 、 Na+ 、 Cl-
C.Ag+ 、 NO3- 、Zn2+ 、Cl- D.Ba2+ 、 OH- 、 Cl- 、 H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com