
20. 在1LK2SO4和CuSO4的混合溶液中,c(SO42-)=2.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中K+的物质的量浓度为( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 1.0 mol·L-1 D. 0.5 mol·L-1
第Ⅱ卷 非选择题(共五大题,50分)
18.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液加入0.1mol Cu2(OH) 2CO3后恰好恢复到电解前的浓度 和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为( )
和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为( )
A.0.2mol B.0.4mol C.0.5mol D.0.6mol
.19.关于下列图示的说法中正确的是( )

A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1︰1
C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
16.用标准盐酸溶液测定某 溶液的浓度,用酚酞作指示剂,下列操作可能使测定结果偏低的是( )
溶液的浓度,用酚酞作指示剂,下列操作可能使测定结果偏低的是( )
A. 酸式滴定管在装液前未用标准盐酸溶液润洗2-3次
B. 开始实验时,酸式滴定管尖嘴部分有气泡,在滴定过程中,气泡消失。
C. 滴定过程中,锥形瓶内溶液立即褪成无色且颜色不再变红。
D. 达到滴定终点时,俯视溶液凹面最低点读数。
1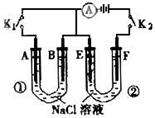 7.如右图所示,A、F为石墨电极,B、E为铁片电极。则下列有关推断错误的是(
)
7.如右图所示,A、F为石墨电极,B、E为铁片电极。则下列有关推断错误的是(
)
A.当打开K2,闭合K1时,装置①为原电池
B.当打开K1,闭合K2时,装置②为电解池
C.在U形管②中滴入酚酞试液,当打开K1,闭合K2时 , E极周围溶液显红色
, E极周围溶液显红色
D.在U形管①中滴入酚酞试液,当打开K2,闭合K1时,B极周围溶液显红色
15.0.1mol/L的NaOH溶液0.2L,通入448mL(标准状况)CO2气体,所得溶液离子浓度大小关系正确的是 ( )
A.c(Na+)>c(H CO3-)>c(OH-)>c(H2 CO3)>c(CO32-)>c(H+)
B.c(Na+)+ c(H+)= c(H CO3-)+c(CO32-)+c(OH-)
C.c(CO32-)+c(OH-)=c(H+)+c(H2 CO3)
D.c(Na+)=c(H2 CO3)+c(H CO3-)+c(CO32-)+c(OH-)
14. 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。则下列有关说法中正确的是( )
A.X的氢化物溶于水显酸性 B.Y的氧化物是离子化合物
C.Z的氧化物的水化物一定是强酸
D.X和Z的最高价氧化物对 应的水化物都是弱酸
应的水化物都是弱酸
13.下列溶液中有关微粒的物质的量浓度的比较正确的是 ( )
A.常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液, ①与②比较 c(H+):①<②
B.常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:
c(Na+)= c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-)
C.相同条件下,pH=9的①CH3COONa溶液、②NH3·H2O溶液、③NaOH溶液中,由水电离出的c(OH-):①>②>③
D.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)]
12.不久前,某海军航空站安装了一台250kW的MCFC型燃料电池。该电池可同时供应电和水蒸气,其工作温度为600℃-700℃,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2,则下列推断正确的是( . )
A.正极反应为:4OH-=O2+2H2O+4e-
B.放电时CO32-向负极移动
C.电池供应1mol水蒸气,转移电子4mol
D.放电时CO32-向正极移动
11.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、 、
、 、S2- ② K+、Fe2+、
、S2- ② K+、Fe2+、 、
、 ③ Na+、
③ Na+、 、
、 、
、
④Na+、Ca2+、 、HCO3- ⑤
K+、Ba2+、
、HCO3- ⑤
K+、Ba2+、 、
、
A.①③ B.③⑤ C.③④ D.②⑤
10.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:


 。下列叙述不正确的是
。下列叙述不正确的是
A. 放电时锌做负极
B. 充电时氢氧化铁被氧化
C. 充电时电池的正极和电源的正极相连
D. 放电时每转移3 mol e-,有2mol  被还原
被还原
8.25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7。若x= y,则x为 ( )
y,则x为 ( )
A.2 B.4 C.3 D.5
9,为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG= ,则下列叙述正确的是 ( )
,则下列叙述正确的是 ( )
A.中性溶液的AG=1 
B.酸性溶液的AG<0
C. 常温下0.lmol/L氢氧化钠溶液的AG=12
常温下0.lmol/L氢氧化钠溶液的AG=12
D.常温下0.lmol/L盐酸溶液的A G=12
G=12
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com