
13.下列关于下列各图的说法,正确的是( )
A.①装置中阴极处产生的气体能够使湿润淀粉KI试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应

12.有浓度均为0.1mol/L①醋酸溶液②氯化铵溶液③硫酸溶液各25mL。下列说法正确的是( )
A.三种溶液pH大小的顺序是①>②>③
B.若将三种溶液稀释相同倍数,pH变化最大的是①
C.三种溶液中由水电离产生的氢离子浓度大小顺序是②>①>③
D.若分别加入25mL 0.1mol/L的氢氧化钠溶液后,pH最大的是①
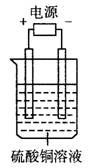
11.如图电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。下列说法正确的是( )
|
序号 |
电极材料 |
通电后的变化 |
|
|
阴极 |
阳极 |
||
|
A |
石墨 |
石墨 |
阴极质量增加,溶液的pH增大 |
|
B |
铜 |
铜 |
阳极质量减小,阴极质量增加 |
|
C |
铁 |
铁 |
两极的质量不发生变化 |
|
D |
铂 |
铁 |
阴极质量增加,溶液的pH不变 |
10.常温下,0.1 mol·L-1某一元酸(HA)溶液中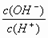 =1×10-8,下列正确的是( )
=1×10-8,下列正确的是( )
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.0.1mol/L的NaA溶液中的离子浓度大小关系为:c(Na+)>c(A-) >c(H+)>c(OH-)
C.该溶液中水的离子积常数为1×10-22
D.用0.1 mol·L-1NaOH溶液V1 L 与0.1 mol·L-1该一元酸(HA)V2 L溶液混合,若混合溶液的pH = 7,则V1<V2
9.下列溶液中各微粒的浓度关系正确的是( )
A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
c(NH4)2SO4>c(NH4HSO4)>c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液:c(Na+)>c( HCOO-) >c(H+) >c(OH-)
C.某二元弱酸的酸式盐:c(H+)+c(Na+) =c(A2-)+c(HA-) +c(OH-)
D.1.0mol/LNa2CO3溶液:c(OH-) = c(H+)+c(H2CO3) +c(HCO3-)
8.下列各组离子,在所给的条件下能够大量共存的是( )
A.在pH=0的溶液中:Fe2+ Mg2+ SO42- NO3-
B.由水电离出的c(H+)=1×10-12mol/L的溶液中:HCO3- K+ Na+ S2-
C.在AlCl3溶液中:SO32- Na+ CO32- AlO2-
D.在滴加酚酞试液后呈红色的溶液中:I- Na+ S2- AlO2-
7.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大 小。按照“酸碱质子理论”,下列说法正确的是( )
A.2Na + 2H2O=2NaOH + H2↑是酸碱反应
B.ClO-+ H2O HClO
+ OH-是酸碱反应
C.碱性强弱顺序:OH->ClO->CH3COO-
HClO
+ OH-是酸碱反应
C.碱性强弱顺序:OH->ClO->CH3COO-
D.HCO3-既是酸又是碱,NH3既不是酸又不是碱
6.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( )
A.SO2 B.Cl- C.Fe3+ D.NO3 ¯
5.下列关于反应能量的说法正确的是 ( )
A.CaCO3(s)=CaO(s)+CO2(g);△H=+187.5kJ·mol-1,E反应物>E生成物
B.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);
△H=-216kJ·mol-1,E反应物>E生成物
C.H1(g)= H2(g)+
H2(g)+ I2(s);△H=+25.6kJ·mol-1,HI在密闭容器中分解后放出26.5kJ的能量
I2(s);△H=+25.6kJ·mol-1,HI在密闭容器中分解后放出26.5kJ的能量
D.H+(aq)+OH(aq)=H2O(1);△H=-57.2kJ·mol-1,含1molNaOH水溶液与含0.5molH2SO4的浓硫酸混合后放热57.2kJ
4.运用元素周期定律分析下列推断,其中错误的是 ( )
A.铍是一种轻金属,它的氧化物的水化物可能具有两极
B.砹单质是一种有色固体,砹化氢很不稳定,砹化银是有色难溶于水且感光性很强的
固体
C.硫酸锶是难溶于水的白色固体
D.硒化氢是无色、有毒,比硫化氢更稳定的气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com