
1.“自宋以降,仗义死节之士远轶前古,论者以为程朱讲学之效。”材料表明程朱理学对宋代以后中国社会的影响突出表现为
A.促进文化教育普及 B.成为维护封建统治的工具
C.压抑了人的个性发展 D.重建了人们的价值信仰
7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL 5%KSCN溶液和2.5
mLpH=4的 HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度。
(2)制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,
加入2 mL蒸馏水溶解,再加入2 mL 1∶1 HNO3溶液,小心加热2-3min。冷却
后,全部移入100 mL容量瓶中,再加入4.0 mL 5%KSCN溶液和10.0 mL pH=4
的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL。取25.00 mL
待测液加入与(1)相同规格的比色管中。
(3)比色:将(2)所得比色管中的溶液与(1)各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围。
请回答下列问题:
(1)在含有Fe3+的溶液中加入K SCN溶液,溶液显 色。
SCN溶液,溶液显 色。
(2)完成该实验,还缺少的仪器有 、 。
(3)加入pH=4的 HAc-NaAc缓冲溶液的目的是 。
(4)实验中量取 HNO3溶液、HAc-NaAc缓冲溶液量筒即可,原因是 。
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是 。
(6)若测得待测液中Fe3+的物质的量浓度为cmol/L,药片的质量为m,则药片中铁元素的质量分数为 。
江苏省苏北四市2010届高三上学期期末联考
20.选做题:本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,每题12分。请选择其中一题作答,并把所选题目对应字母后的方框涂黑。若两题都作答,将按A题评分。
A.“物质结构与性质”
下表为长式周期表的一部分,其中的字母代表相应的元素。
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b |
c |
d |
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
f |
|
g |
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
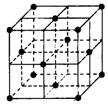 试回答下列问题:
试回答下列问题:
(1)元素h的二价阳离子的基态电子排布式为 。
(2)在1185 K时,元素h可形成如图所示基本结构单元的晶体,
则其中h原子的配位数 是
。
是
。
(3)c、d、e、f元素的第一电离能(I1)由小到大的顺序
为 。(用相应元素符号表示)
(4)表中所列的元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是 。邻甲基苯甲醛分子中碳原子轨道的杂化类型为 。1 mol 苯甲醛分子中σ键为 mol。
(5)一种由表中元素形成的离子与单质d3互为等电子体,其化学式为 。
B.“实验化学”
为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了 以下实验研究。
以下实验研究。
[实验原理]有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量。
[实验用品]2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5% KSCN溶液、pH=4的HAc-NaAc缓冲溶液、1∶1 HNO3溶液、复方硫酸亚铁药片。
铁架台(铁夹)、100 mL容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉
网、酒精灯、玻璃棒、25 mL比色管、pH试纸。
[实验过程]
(1)配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、
19.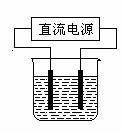 (10分)以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(10分)以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)电解饱和食盐水的化学方程式为 。
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置
进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到
标准状况下氢气2.24 L。(设电解前后溶液的体积均为1 L,
不考虑水的蒸发或气体的溶解)
①理论上,电解后溶液的pH= 。
②若实际测得反应后溶液的pH=13.00,则造成这种误差的原因可能是:
a.氯气和氢氧化钠溶液反应
b.还可能为(用化学方程式表示): 。
若是原因b,则电解过程中溶液减小的质量是 。
(3)若溶液实际减少的质量为4.23 g,则所产生的气体的物质的量之比是多少?
(写出计算过程)
18.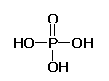 (12分)高分子材料M在光聚合物和金属涂料方面有重要用途。
(12分)高分子材料M在光聚合物和金属涂料方面有重要用途。
|

 M可以用丙烯为原料,通过如下图所示的路线合成:
M可以用丙烯为原料,通过如下图所示的路线合成:
回答下列问题:
(1)写出E中两种官能团名称 和 。
(2)C→甲基丙烯酸的反应类型为 。
(3)符合下列条件的甲基丙烯酸的链状同分异构体数目为 (含甲基丙烯酸)。
①能与溴水反应褪色;②与Na2CO3溶液反应放出CO2气体
(4)A→B的反应中还可能生成一种有机副 产物,该副产物的结构简式为
。
产物,该副产物的结构简式为
。
(5)请用反应流程图表示A→丙烯酸的合成线路,并注明反应条件
(提示:氧化羟基的条件足以氧化C=C)。
例:由乙醇合成聚乙烯的反应流程图可表示为:

17.(10分)某硝酸厂附近的空气主要污染物为氮的氧化物。为了保护环境和综合利用,可采用氨-碱两级吸收法。此法兼有碱吸收和氨吸收两法的优点,其吸收工艺流程如下:
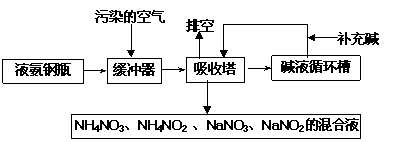
(1)排空物质的主要成分为____________________________。
(2)进入吸收塔以前加一个缓冲器的目的是________________________________。
(3)从吸收塔排出的混合液用途之一为________________ 。
空气的主要污染物为硫的氧化物和氮的氧化物。研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:

各室中发生的反应如下:
a.氧化室:NO2(g) + SO2(g) + H2O (l)=H2SO4 (l)+ NO(g)△H=a kJ·mol-1
b.清除室:NO (g)+ NO2 (g)= N2O3(g) △H= b kJ·mol-1
N2O3 (g)+ 2H2SO4(l) = 2NOHSO4 (s)+ H2O(l) △H=c kJ·mol-1
c.分解室:4NOHSO4 (s)+ O2 (g)+ 2H2O (l)= 4H2SO4 (l)+ 4NO2(g) △H= dkJ·mol-1
回答下列问题:
(4)①和②分别为(写化学式)______________、_____________。
(5)写出SO2、 O2 和 H2O反应生成H2SO4的热化学方程式:
____________________________________________________________。
16.(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: §SO2(g) +1/2O2(g) SO3
SO3 (g) △H=-98 kJ·mol-1。
(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
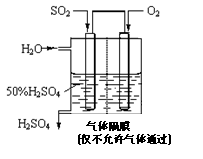 (2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为
。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为
。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以右图所示装置,用电化学原理生产硫酸,写
出通入O2电极的电极反应式为 。
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,
则通入SO2和水的质量比为____________。
15.(10分)重晶石矿石主要含有BaSO4,还含有少量的SiO2、Al2O3、Fe2O3、MnO2、
FeS2、Na2O、K2O等杂质。以下是某工业制备硫酸钡以及分离某些金属的流程图。
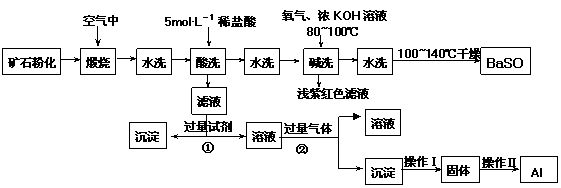
(1)煅烧过程中产生的污染性气体主要是 。
(2)确定第一次水洗液中有K+存在的实验现象是 。
(3)写出碱洗时的氧化还原反应方程式 。
(4)①反应生成沉淀的化学式 ,②反应的离子方程式为 。
(5)操作Ⅰ为 ,操作Ⅱ为 。
14. (8分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作反应的催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
(8分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作反应的催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
已知:Ⅰ.Cu(OH)2、CuO开始分解的温度分别为80℃和900℃。
Ⅱ.有关金属离子从开始沉淀到沉淀完全时溶液的pH:
|
|
开始沉淀的pH |
沉淀完全的pH |
|
Fe3 |
2.7 |
3.7 |
|
Cu2+ |
5.2 |
6.4 |
|
Fe2+ |
7.6 |
9.6 |
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①最好为 (填字母)。
a.(NH4) 2S b.H2O2 c.NaClO d.Cl2
(2)加试剂②的目的是 ,由溶液C获得CuCl2·xH2O,需要经过加热浓缩、 、过滤等操作。
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,有如下两种实验方案:
方案一:称取a g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的
质量为b g。
方案二:称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀(控制温度约为120℃)至质量不再减轻为止,称量所得固体的质量为b g。
则上述两种实验方案中,不合理的是 ,原因是 。
依据合理方案计算得x = (用含a、b的代数式表示)。
13.(6分)工业纯碱中常常含有NaCl、Na2SO4等杂质。为测定某工业纯碱的纯度,设计了如下图实验装置。
 依据实验设计,请回答:
依据实验设计,请回答:
(1)装置中盛装稀硫酸的仪器名称是 ;
装置D的作用是 。
(2)为达到实验目的,一次实验中至少应
进行称量操作的次数为 。
(3)若不考虑操作、药品及其用量等方面
的影响,该实验测得结果会 (填“偏高”、“偏低”、“无影响”);
原因是 (你若认为无影响,该空不用回答)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com