
19. (10分)硝酸铜受热易分解:2Cu(NO3)2  2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO  2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2⇌N2O4,2NO2=2NO+O2等反应)。
2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2⇌N2O4,2NO2=2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
(1)若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是_____________。
(2)若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是______________(填分子式),其体积(标准状况)是_____________L,
(3)若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是______________________g。
(4)设该质量的无水硝酸铜在分解过程中,得到的残留固体质量为xg,生成的气体中NO2和O2的体积比为y,求y与x的关系式: ;
。
18.(12分)从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2mol Cu2O。分析图表并回答问题:
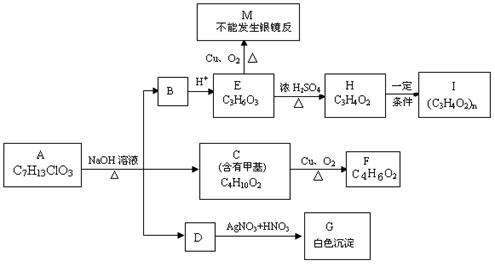
(1)A的结构简式可能为: 、 ;
(2)写出反应类型:E→H ;H→I ;
(3)写出C→F的化学方程式: 。
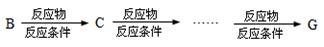
(4)请设计出由丙烯合成CH3-CH(OH)-COOH的反应流程图(无机试剂任选,有机物用结构简式表示)。
提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:
17. 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
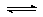 C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
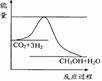 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
16.(16分)硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢:(皓矾为ZnSO4•7H2O)
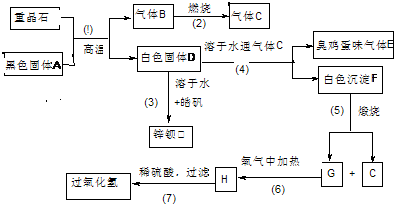
(1)上述流程中共有7个化学反应,其中有____________个属于氧化还原反应。
(2)写出过氧化氢和物质C的电子式:____________________,_______________。
(3)写出F、G的化学式: F_____________、G_________________。
(4)写出下列化学反应方程式:
反应③__________________________________________________________。
反应⑦____________________________________________________。
(5)取锌钡白固体16.5g溶于100mL 1mol/L的H2SO4 溶液中,放出H2S 气体1008mL(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为________mol/L
②加热驱尽溶液中H2S 后,为使锌离子完全沉淀,应加入 1 mol/L的NaOH溶液_____mL
15.(15分)氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝样品中可能含有碳或氧化铝中的一种杂质,现用如图Ⅰ所示的装置来进行检验。使氮化铝样品和氢氧化钠溶液反应:
AlN + NaOH + H2O = NaAlO2 + NH3 ↑ 根据反应中所产生氨气的体积来测定样品的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
(1)  实验有关操作:
实验有关操作:
A.往圆底烧瓶中放入AlN样品w g,并向广口瓶中加入
水和X液体;
B. 往圆底烧瓶中加入一定体积的过量的浓NaOH溶液;
C. 检验装置的气密性;
D.读取收集到的水的体积;
正确的操作顺序为__________________________________________。
(2)本实验中检验装置气密性的方法是_____________________________________。
(3)广口瓶中的试剂X可选用__________________(填选项的标号)
A.丁烷 B. 酒精 C. 植物油 D. 四氯化碳
其理由______________________________________。
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是___________。
(5)实验结束后,量筒中收集到水的体积为a L,若当时的实验条件为标准状况,则样品中AlN的质量分数为______________________(AlN的相对分子质量为41),这一测定结果比实际值偏低,你认为可能的原因是__________________________.
 (6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定
烧杯中硫酸的增重来确定样品AlN的质量分数。你认为
这样的改进是否可行?_____________________(填
“可行”或“不可行”),理由是____________________
_______________________________。
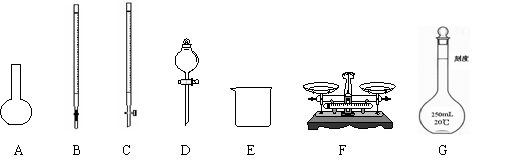
14.(18分)某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③ 量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)步骤②中加入盐酸的作用________________________________________________。
(3)写出步骤④中发生反应的离子方程式 。
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
___Fe2+ + ___ClO3- + = __Fe3+ + ___Cl- + ___H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的NaClO3与Cl2的氧化效率之比为
(5)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 。
(6)本实验需要称量的最少次数是 次,若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2 + 6NaOH  5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
则Fe3+、KClO3、Cl2三种物质其氧化性由强到弱的顺序是_________________________。
13.某活动小组利用右图装置验证NO的还原性及探究工业生产硝酸的原理。(装置气密性已检查完毕)。
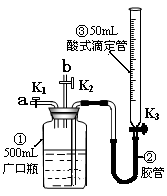 (1)向广口瓶①中通入NO并测定NO的体积
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作: ;
②从导管a通入一定量的NO,并记录滴定管液面变化的
示数为VL(V<50mL,气体体积已换算为标准状况)。
准确测定NO的体积的主要操作:
;
(2)验证NO的还原性;探究工业生产硝酸的原理
①停止通入NO后关闭K1、K3,打开K2,从导
管b缓缓通入O2,可观察到的现象是 ,
写出对应现象的化学反应方程式 、
;
②继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
i 当通入氧气的体积为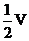 时,则广口瓶①的气体体积为
;
时,则广口瓶①的气体体积为
;
ii当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为 mol/L。
12.一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g)△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g)△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
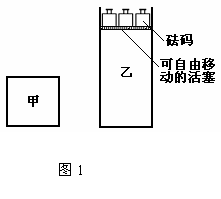
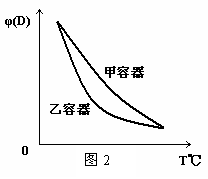
下列关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成不相同,混合气体平均相对分子质量也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
第II卷(非选择题 ,共78分)
11. 有关下图所示化合物的说法不正确的是
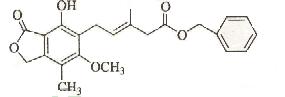
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1mol该化合物最多可以与3molNaOH反应
C.既可以催化加氢,又可以使酸性KmnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
10. 下列说法不正确的是
A.室温下,pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7
B.某溶液中加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变混浊,原溶液中一定含有大量CO32-或SO32-
C.某试液中加入盐酸酸化的氯化钡溶液,有白色沉淀,该溶液中一定含有SO42-
D.0.1mol/L弱酸HA溶液与 0.05mol/LNaOH溶液等体积混合后,所得溶液微粒浓度是
2c(H+) + c(HA) = c(A-) + 2c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com