
5.函数 的零点个数是
( )
的零点个数是
( )
A. 0
B. 1
C. 2
D.3 
4.若复数 在复平面上对应
在复平面上对应
的点位于
( )
A.第一象限
B.第二象限 C. 第三象限 D. 第四象限
3.由1,2,3三个数字组成的无重复数字的两位数字中,任取一个数,则恰为
奇数的概率是
( )
A.  B.
B.
 C.
C.
 D.
D.


2. ( )
( )
A.充分不必要条件 B.必要不充分条件 C. 充要条件
D. 即不充分也不必要条件
1.设 ( )
( )
A.  B.
B.
 C.
C.  D.
D.
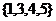

15.(12分)在标准状况下,取甲、乙、丙各30.0mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(设反应前后溶液体积不发生变化):
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
255 |
385 |
459 |
|
气体体积/ mL |
280 |
336 |
336 |
请回答:
(1)甲组实验中,盐酸(选填“过量”“适量”或“不足量”,下同) ;丙组实验中盐酸 。
(2)盐酸的物质的量浓度为 。
(3)合金中Mg、Al的物质的量之比为 。
14.(12分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
(1)在冶炼过程中反应温度对生成金属镁的影
响如图,从图中分析,还原反应的反应热
△H 0(填“<”“>”“=”);理由是:
。
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl••MgCl2• 6H2O),其中
KCl••MgCl2• 6H2O属于 。
A.复盐 B.混合物 C.配合物 D.混盐
(4)写出下列反应的方程式
①煅烧白云石 。
②CaO•MgO与Si的反应 。
13.(14分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案
如下:
试回答下列问题:
(1)过滤用的玻璃仪器有 。
(2)写出滤液A转化为沉淀D的离子方程式 。
(3)由滤液A制AlCl3溶液的途径有Ⅰ和Ⅱ两条,你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是 。
(4)从滤液E中得到绿矾晶体的实验操作是 。
(5)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式为 。
(6)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理? ;理由是
。
12.(14分)某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色黑体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)写出反应中所形成原电池负极的电极反应式: 。
(4)欲利用此反应测定合金中铝的金属,理论上还应该测定哪些数据?请仿照方法①写出另一种不同方法所需数据。
|
方法 |
需测定的数据 |
|
① |
测定产生的H2的体积 |
|
② |
|
[实验二](5)向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式: 。
[实验三]取实验二的锥形瓶里的溶液10mL,向其中商加a mLC1mol·L-1NaOH之后,
改成滴加C2mol·L-1HCl,所得沉淀Y(mol)与所加试剂总体积V(mL)间的关系如下图所示。
据此,回答下列问题:
(6)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体
积的两倍,则C1/C2= ;
(7)所加入NaOH溶液的体积a = mL。
11.(8分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向溶液中滴加稀硫酸至溶液pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 、 等玻璃仪器。
(2)步骤1过滤的目的是 。
(3)当步骤2中溶液的pH=8-9时,检验沉淀是否完全的方法是
。
(4)步骤2中溶液的pH较难控制,可改用 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com