
18.(9分)A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B是第三周期中离子半径最小的元素,且其原子最外层电子数为D元素原子最外层电子数的一半。A元素原子最外层电子数比B多一个。甲、乙、丙是三种元素最高价含氧酸的含钠元素的盐,甲中含B元素,乙中含D元素,丙中含A元素。 甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)

回答下列问题:
(1)B的元素符号为: ;乙的化学式为 ;
(2)己溶液与丙溶液反应的离子方程式为 。
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生反应;但生成物不是己和丁,写出将少量的乙溶液滴入甲溶液反应的离子方程式: ;
(4)若用乙溶液为标准液来滴定未知浓度的丙溶液,则乙应当盛放在 滴定管中(填酸式、碱式)。若选用酚酞为指标剂,则滴定终点的产物为 。
 19.(13分)某兴趣小组的学生根据Mg与CO2反应原理推测钠也
19.(13分)某兴趣小组的学生根据Mg与CO2反应原理推测钠也 能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑色的Pd)。请回答下列问题:
能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑色的Pd)。请回答下列问题:
(1)上图装置2中应盛放 溶液。
(2)为了使反应随开随用,随关随停,上图方框内应选用 装置(填上图字母代号)。
(3)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行1装置的操作,待装置
(填数字编号)中出现
现象 时,再点燃酒精灯,这步操作的目的是
。
时,再点燃酒精灯,这步操作的目的是
。
(4)①若装置6中有黑色沉淀生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰 水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为
。②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能澄清石灰水变浑浊的气体放出,则钠与二氧化
水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为
。②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能澄清石灰水变浑浊的气体放出,则钠与二氧化 碳反应的化学方程式为
。
碳反应的化学方程式为
。
 (5)该小组查阅资料认为,不
(5)该小组查阅资料认为,不 仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳。当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否有Na2CO3、Na2O和C:
。
仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳。当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否有Na2CO3、Na2O和C:
。
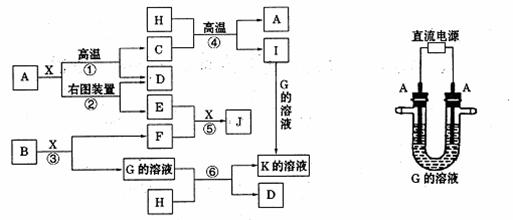 20.(11分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
20.(11分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
(1)写出B的电子式: 。
(2)反应⑤的现象是 。
(3)反应①的化学反应方程式是
;在实验室引发反应④的操作是
 。
。
(4)反应⑥的离子方程式 是
。
是
。
(5)写出上 述电解装置中阴极的电极反应式
。
述电解装置中阴极的电极反应式
。
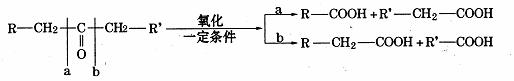 21.(12分)已知:
21.(12分)已知:
 现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
试回答下列问题:
(1)写出下列物质的结构简式 :A C
D
;
:A C
D
;
A中所含的官能团名称: 。
(2)写出反应①和②的反应类型:反应① 反应②
(3)写出下列变化的化学方程式:①F→G ②A→H 。
17.(7分)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感疫情,随后也不断蔓延我国各地。防控专有表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由K ClO3在H2SO4存在的条件下与Na2SO3反应制得。请写出反
ClO3在H2SO4存在的条件下与Na2SO3反应制得。请写出反 应的离子方程式
。
应的离子方程式
。
(2)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示 为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠下列物质均会发生化学反应而失效,其
为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠下列物质均会发生化学反应而失效,其 中过碳酸钠只发生了还原反应的是
。
中过碳酸钠只发生了还原反应的是
。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年,但亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1mol HClO2发生分解反应时,转移的电子个数是 。
16.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入 3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。则下列叙述中不正确的是 ( )
3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。则下列叙述中不正确的是 ( )
A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL
B.当金属全部溶解时收集到NO气体的体积一定为2.24L
C.参加反应的金属的总质量为9.6g>m>3.6g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
15.一定温度下,在体积为VL的密闭容器中加入1molX和1molY进行如下反应:
 X(g)+Y(g) 2Z(g)+W(s);△H>0达到平衡,下列判断正确的是 ( )
X(g)+Y(g) 2Z(g)+W(s);△H>0达到平衡,下列判断正确的是 ( )
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后加入X,上述反应的△H增大
C.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的1/2
D.当容器中混合气体的压强不变时,容器内混合气体的平均相对分子质量不再变化
13.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
|
|
 3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH‑=Zn(OH)2
B.充电时阳极反应为:F1e(OH)3-3e-+5OH-=F1eO2-4+4H2O
 C.放电时每转移3mol电子,正极有1molK2FeO4被还原
C.放电时每转移3mol电子,正极有1molK2FeO4被还原
D.放电时正极附近溶液的pH不变
 14.国际奥委会公布的违禁药物目前有一百多种,某种兴奋剂的结构如图,关于它的说法正确的是 ( )
14.国际奥委会公布的违禁药物目前有一百多种,某种兴奋剂的结构如图,关于它的说法正确的是 ( )
A.该物质是芳香烃
B.它的分子中所有碳原子共平面
C.1mol该物质最多能与2mol氢氧化钠反应
D.1mol该物最多能与4molH2发生加成反应
12.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.10mL 0.5 mol·L-1CH3COO
mol·L-1CH3COO Na与6mL 1mol·L-1盐酸混合:c(Cl-)>c(
Na与6mL 1mol·L-1盐酸混合:c(Cl-)>c( Na+)>c(OH-)>c(H+)
Na+)>c(OH-)>c(H+)
B.0.1mol·L-1pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)2==c(HA-)+c(OH-)+c(A2-)
D.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
11.下列离子方程式正确的是 ( )
A.苯酚钠溶液中通入少量CO2:CO2+H2O+C6H5O-→C6H5OH+HCO-3
B.4mol的Cl2通入含3molFeBr2的溶液中:2Fe2++6Br-+4Cl2=2Fe3++6Cl-+3Br2
C.用稀硝酸溶解FeS固体:FeS+2H+==Fe2++H2S↑
 D.NaHS水解反应:HS-+H2O H3O++S2-
D.NaHS水解反应:HS-+H2O H3O++S2-
10.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规 律。如:
律。如:
Na2O2+SO2==Na2SO4、2Na2O2+2SO3==2Na2SO4+O2,据此,你认为下列反应方程式中不正确的是 ( )
A.2 Na2O2+2Mn2O7==4NaMnO4+O2↑ B.2Na2O2+P2O3=Na4P2O7↑
C.2Na2O2+2N2O3==4NaNO2+O2↑ D.2Na2O2+2N2O5=4NaNO3+O2↑
8.海带中含碘元素,从海带中提取碘有如下步骤:①通入足量Cl2。②将海带焙烧成灰后加水搅拌。③加CCl4振荡。④用分液漏斗分液。⑤过滤。则合理的操作顺序是 ( )
)
A.①②③④⑤ B.②⑤①③④ C.①③⑤②④ D.②①③⑤④
 9.用右图表示的一些物质或概念间的从属关系中不正确的是 ( )
9.用右图表示的一些物质或概念间的从属关系中不正确的是 ( )
|
|
X |
Y |
Z |
|
A |
苯的同系物 |
芳香烃 |
芳香族化合物 |
|
B |
胶体 |
分散系 |
混合物 |
|
C |
置换反应 |
氧化还原反应 |
离子反应 |
|
D |
碱性氧化物 |
金属氧化物 |
氧化物 |
5.用NA表示阿伏加德常数的值。下列叙述正确的是 ( )
A.标准状况下的33.6mL氯气通入足量水中,转移电子数为1.5×10-3NA
B.标准状况下,22.4L四氯化碳中共价键数目为4NA
C.1L浓度为1m ol·L-1的NaCO3溶液中含有3NA个离子
ol·L-1的NaCO3溶液中含有3NA个离子
D.合成氨反应达到平衡时,每形成1NAN≡N键的同时,就有6NAN-H键形成
 6.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是 ( )
6.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是 ( )
A.装置①常用于分离沸点不同的液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4Cl为原料,装置③可用于实验室制备少量NH3
D.装置④由b口进气可收集CO2、NO等气体
 7.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )
7.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含有6.02×1022个碳原子
C.石墨烯是一种有机物
D.石墨烯中的碳原子间以共价键 结合
结合
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com