
由高考的性质决定,高考复习中,既要高度重视基础,又要着重对学生数学能力与综合素质的培养与提高,因而确定以夯实“三基”为根本,强化训练为手段、培养能力为目的的复习指导思想。有了明确的复习指导思想,增强复习行为的自觉性、目的性,提高复习效率。下面为论述方便分门别类,实际上复习自始至终是一个整体,应有全局观。
(二)对中学数学教学的启示
1.基础知识的教学和复习要在形成知识体系上下功夫
切实掌握数学知识是顺利解答问题的基础,在教学和复习过程中,要注意知识的不断深化,新知识应及时纳入已有的知识体系,特别要注意数学知识之间的关系和联系,逐步形成的扩展知识结构系统,使学生能在大脑记忆系统中构建“数学认知结构”,形成一个条理化、有序化、网络化的有机体系。这样在解题时,能由题目提供信息的启示,从记忆系统里检索出有关信息进行给合,寻找解题途径,能选取出与题目的信息构成最佳组合的信息者,可优化解题过程。
2.能力培养要落到实处
要“加强能力培养”已众所周知,近年来高考的情况表明,中学生数学能力的提高并不尽人意,特别是试题的能力要求稍高,便有不少考生不能适应,这值得我们深思,在能力培养的实际操作上需要怎样改进?数学能力可以在数学知识学习过程中自发地形成和发展,但是如果能自觉地加强培养,则可以大大加速能力的形成和发展过程,重要的是有意识地把数学教学过程施行为数学思维活动的过程,解题教学要让学生思维得以充分的暴露,教师能沿着学生的思维轨迹因势利导,克服盲目性,提高自觉性。解题之后要注意反思,总结出是怎样发挥数学能力的效应来指导解题的。研究数学问题解题过程中的不同思维层次,是提高能力的一个有效方法,要不断总结经验,使能力培养真正落到实处。
3.要重视培养学生创新意识和实践能力
今年的试题进一步加强了创新意识和实践能力的考查,这是社会发展的要求。数学作为一门基础学科,一门思维学科,是培养学生的创新意识和实践能力的主渠道之一。要激发学生的主体意识,让学生积极、主动地参与教学和复习的全过程,进行独立思考,提高独立解决问题的能力。要培养学生大胆创新、敢于求异、勇于探索的精神,形成良好的思维品质,为高校输送高质量的创新人才。
总之,2001年高考数学试题,贯彻了“继承经验,稳定发展、改革创新、突出选拔”的思想,稳中求变、求新,突出能力考查。试题符合《考试说明》的各项规定,考试内容与能力要求恰当合理,试题和试卷的结构严谨科学,达到了选择性考试的要求。题型设计继承和发扬了多年高考数学试题所形成的“立意鲜明、取材讲究、形式多样、难点分散、层次分明”等优点,并且有所创新和发展,增强了考试的活力,试题一方面保持了近年来连续稳定的风格,另一方面,加大了创新的力度,体现了有利于培养创新能力和选拔人才。
12. (16分 (3)小题4分 其他每空3分)
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,
有的是香料。它们的结构简式如下所示:

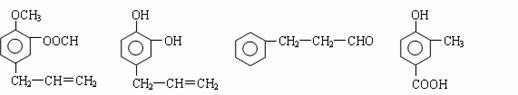
A B C D
请回答下列问题:
(1)用A、B、C、D填空:①能发生银镜反应的有 。
②既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有 。
(2)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于 反应(填反应类型名)写出反应②的化学方程式:

(3)同时符合下列两项要求的D的同分异构体有4种:
① 化合物是1,2-二取代苯;
② 苯环上的两个取代基分别为羟基和含有-COO-结构的基团。
其中两种(G和H)结构简式如下图所示,请写出另外两种异构体。
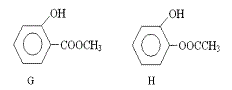
选择
1-6 B C C B A D 7-8 CD BC
非选择题
9(18分 每空3分)
(1)引流 (2)C (3) MnO2
(4)
|
实验目的 |
操作 |
实验现象 |
结论 |
|
1、检验Cl- |
取少许滤液于试管中, 加入硝酸酸化的硝酸银溶液
|
有白色沉淀产生
|
含有Cl- |
|
2、检验NH4+ |
取少许滤液于试管中,
加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 |
石蕊试纸变蓝色
|
含有NH4+ |
10(15分 每空3分)
(1)ab (2)C (3)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
(4)ac BaSO4
11(15分 每空3分)
(1) 0.0003 mo1·L -1·min-1
(2) ① <; ② V 2/a2 ③增大;不变
12 (16分 (3)小题 4分 其他每空3分)
(1)①A、C ② D

|


(3)
11、(15分每空3分)
(1)
在一定条件下,容积为 100 L密闭容器中发生反应:CH4(g)+H2O(g) 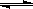 CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器 l0 min时有0.1 mol CO生成,
则10 min内该反应的平均速率v(H2) 。

(2) 在压强为0.1 MPa条件下,容积为V L某密闭容器中
a mol CO与 2a mol H2在催化剂作用下
反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
CO的转化率与温度、压强的关系如图。
①该反应的△H 0 (填“<”、“>”或“=”)。
② 100℃时该反应的平衡常数K= (用含a、V的代数式表示)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,
CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”)。
7.下列实验不能达到目的的是( )
A.往酸性KMnO4溶液中通入SO2验证SO2的还原性
B.加热氯化铵与氢氧化钙固体混合物制取氨气
C.用二氧化锰和稀盐酸反应制取氯气 D.用乙醇萃取碘水中的碘
8  25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
 A .均存在电离平衡和水解平衡
A .均存在电离平衡和水解平衡
B.
存在的粒子种类不相同
C.  均存在C(Na+)+ C(H+)= c(CO32-)+
C(OH-)+c(HCO3-)
均存在C(Na+)+ C(H+)= c(CO32-)+
C(OH-)+c(HCO3-)
D Na2CO3溶液 C(Na+)> c(CO32-)> C(OH-)> c(HCO3-)

非选择题
9(18分 每空3分)某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:

普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作②玻璃棒的作用 ;
(2)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中
还存在的物质为 ( 填化学式)
(3) 操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步
认定黑色固体为 ( 填化学式)。
(4 ) 该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验
报告,请你写出其空白处的内容:(答案写在答题卷上)
|
实验目的 |
操作 |
实验现象 |
结论 |
|
1.检验Cl- |
取少许滤液于试管中,加入
|
产生白色沉淀 |
含有Cl- |
|
2.检验NH4+ |
取少许滤液于试管中,加入
|
|
含有NH4+ |
|
3.检验Zn2+ |
取少许滤液于试管中,加入稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
10(15分 每空3分)硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理
用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,
原料中的Fe3+必须先还原为Fe2+。实验步骤如下:

(1) 用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 玻璃棒 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是 和确定氧化Fe2+所需NaClO3的量
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全
(c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平
__ Fe2++__ClO3-+__H+= __Fe3++_Cl-+__
(4)聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列提供选择的试剂和
基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和 的质量(填写化合物的化学式)。
6.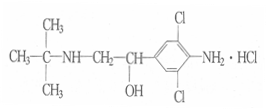 《化学教育》报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件。这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构可表示如图下列关于“瘦肉精”的说法中正确的是( )
《化学教育》报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件。这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构可表示如图下列关于“瘦肉精”的说法中正确的是( )
A.摩尔质量为313.5 g B.属于芳香烃
C.不能发生加成反应 D.分子式为C12H19Cl3N2O
7-8双选择题 (每题6分)
4.下列离方程式书写正确的是( )
A.石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3
B.NH4HCO3溶液与足量的NaOH溶液混合加热:
NH4++HCO3-+2OH- NH3Ÿ+CO32-+2H2O
NH3Ÿ+CO32-+2H2O
C.酸性条件下KIO3溶液与KI溶液发生反应生成I2: IO3-+5I-+3H2O=3I2+6OH-
D.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+
5 .下列叙述不正确的是
A.铁表面镀锌,铁作阳极 B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-
D.工业上电解饱和和食盐水的阳极反应:2Cl--2e-=Cl2↑
3.用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.常温常压下的33.6L氯气与足量铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.在1mol Na2O2晶体中阳离子与阴离子总数为4NA
2.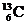 -NMR(核磁共振)可用于含碳化合物的结构分析,
-NMR(核磁共振)可用于含碳化合物的结构分析,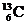 表示的含义错误的是
表示的含义错误的是
A.表示碳元素的一种同位素 B.表示碳元素的一种核素
C.质量数是13,原子序数是6,核内有7个质子
D.质量数是13,原子序数是6,核内有7个中子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com