
20.(10分)铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)铬元素以Cr2O72-离子的形式存在于酸性废水中,其水溶液中存在的平衡体系为 。(用离子方程式表示)
 (2)常用FeSO4将其还原为Cr3+离子,再用沉淀法进行分离。
(2)常用FeSO4将其还原为Cr3+离子,再用沉淀法进行分离。

 已知:Cr3+ Cr(OH)3 CrO2-
已知:Cr3+ Cr(OH)3 CrO2-
① FeSO4还原Cr2O72-的离子方程式为_____________________。
② Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为_______________。
③ 沉淀法分离废水中的Cr3+离子,pH应控制在__________范围内。
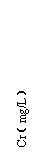
 (3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
(3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
说明:1--用蒸馏水浸溶, 2--用稀硫酸浸溶,
3--冻融后用蒸馏水浸溶,4--曝晒后用蒸馏水浸溶;
3%等--制砖时含铬废渣掺入的比例。
已知我国规定“固体废弃物浸出标准值含铬不得超过10 mg·L-1”。分析图表,可得出多个结论:
① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可)
________________________________________________________;
______________________________________________________。
天津市五校2010届高三上学期期中联考化学答题纸
I、选择题
II、填空题
19.(9分)目前工业上有一种方法是用 生产燃料甲醇。一定条件下发生反应:
生产燃料甲醇。一定条件下发生反应:

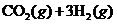
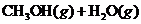 ,右下图表示该反应进行过程中能量(单位为
,右下图表示该反应进行过程中能量(单位为 )的变化。
)的变化。
(1)关于该反应的下列说法中,正确的是 。
A.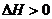 ,
,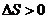 ;
B.
;
B.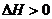 ,
,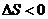 ;
;
C.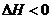 ,
,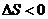 ;
D.
;
D.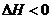 ,
,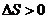 。
。
(2)该反应平衡常数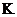 的表达式为
。
的表达式为
。
(3)温度降低,平衡常数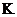 (填“增大”、“不变”或“减小”)。
(填“增大”、“不变”或“减小”)。
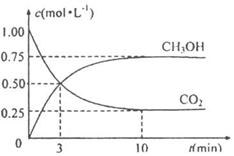 (4)为探究反应原理,现进行如下实验:在体积为
(4)为探究反应原理,现进行如下实验:在体积为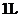 的密闭容器中,充入
的密闭容器中,充入
 和
和
 ,测得
,测得 和
和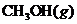 的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率
的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率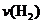 为:
为:
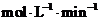 。氢气的转化率
。
。氢气的转化率
。
(5)下列措施中能使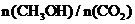 增大的有
。
增大的有
。
A.升高温度;
B.加入催化剂;C.将 从体系中分离;
从体系中分离;
D.再充入
 和
和
 ; E.充入
; E.充入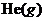 ,使体系总压强增大。
,使体系总压强增大。
18.(16分)下表是元素周期表的一部分,针对表中的①-⑩种元素,填写下列空白(用元素符号或化学式表示)。
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
① |
② |
③ |
|
|
|
3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)用电子式表示⑦的单质分子的形成过程
________________________________。
(2)④⑤⑥⑦元素的最高价氧化物所对应的水化物中,酸性最强的化合物是_________;元素的最高价氧化物所对应的水化物中,碱性最强的化合物是_________,具有两性的化合物是_______。
(3)地壳中含量最多的元素是______,常温下呈液态的非金属单质是________。
(4)元素③的氢化物分别与元素⑦、元素⑨的单质反应的化学方程式分别是__________________________________;__________________________________.
(5)用电子式表示元素④与⑩形成化合物的过程____________________________________。它们以_________键结合。
(6)在③、④、⑤、⑥这四种元素的原子中,原子半径最小的是_________。
(7)在③、④、⑤、⑥、⑨这四种元素的单质中,还原性最强的是______。
17.(11分)甲、乙两池的电极材料都是铁棒和碳棒,请回答下列问题:
(1)若两池均为CuSO4溶液,反应一段时间后:
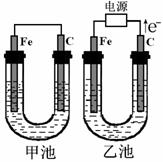 ①有红色物质析出的是甲池中的_____棒;乙池中的______棒
①有红色物质析出的是甲池中的_____棒;乙池中的______棒
②乙池中阳极的电极反应式为___________________
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式
___________________________________________
②甲池中碳极上电极反应式是
_______________________________________________,
乙池中碳极上电极反应属于_____________(填“氧化反应”或“还原反应”)
③若乙池转移0.2mol e-后停止实验,池中溶液体积是200mL,则溶液混匀后的pH=______.
16.(9分)请完成下列有关氧化还原的问题:
(1)已知氧化性BrO3->ClO3->Cl2>IO3->I2 。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
①可观察到的现象是_______________________________________
②写出有关的离子方程式_____________________________________.
(2)一个完整的氧化还原反应可以拆写成两个“半反应”,一个是氧化反应,另一个是还原反应;如2Fe3++Cu==2Fe2++Cu2+
拆写的结果是:氧化反应Cu-2e-==Cu2+;还原反应Fe3++e-==Fe2+,据此,请将反应3NO2+H2O==2H++2NO3-+NO 拆写成两个“半反应”式:
氧化反应:__________________________________________________。
还原反应:__________________________________________________。
15. (3分)过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(3分)过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是 。
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是: 。
A. BaO 2 + H2SO 4 === BaSO4 ↓ + H2O2
B. 2NH4HSO4 (NH4)2S2O8 +
H2↑,
(NH4)2S2O8 +
H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
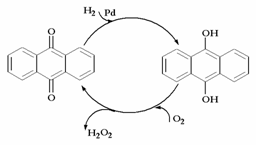
D.蒽醌法:
14. 右图是从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
右图是从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
A.配制200.0 mL 4.6 mol·L-1的稀硫酸需取该硫酸50.0 mL
B.该硫酸50.0 mL与足量的铁反应可得到标准状况下H2 20.3 L
C.该硫酸与等体积的水混合所得溶液的质量分数小于49%
D.该试剂的物质的量浓度为9.2 mol·L-1
第II卷(非选择题) 本卷包括5小题,共58分
12.做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:
MnO4-+H2C2O4+H+→CO2↑+Mn2++ 。下列有关叙述正确的是
A.发生还原反应的是H2C2O4
B.该离子方程式右侧方框内的产物是OH
C.1 mol草酸分子中含有9 mol共用电子对
D.10 mol H+参加反应时,电子转移5 mol
|
11.对于某温度下平衡体系mA(g) + nB(g) pC(g) + qD(g)
△H<0,下列说法不正确的是
pC(g) + qD(g)
△H<0,下列说法不正确的是
A.若温度不变,将容器容积扩大到原来的2倍,此时A的浓度变为原来的0.52倍,则 m + n > p + q
B.向平衡体系中加入C、D,该反应的△H减小
C.若温度和容器体积不变,充入一定量的稀有气体,B的浓度不变
D.若平衡时,A、B的转化率相等,说明反应开始时,A、B物质的量之比为m∶n
10.已知酸H2B在水溶液中存在下列关系:
①H2B
= H+ + HB-,②HB-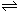 H+
+ B2- ,则下列说法中一定不正确的是
H+
+ B2- ,则下列说法中一定不正确的是
A.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
B.在Na2B溶液中一定有:c (Na+)=2(c (B2-)+c (HB-) + c (H2B) )
C.NaHB水溶液中一定有:c (Na+) + c (H+) = c (HB-) + c (OH-) +2 c (B2-)
D.在Na2B溶液中一定有: c (OH-)=c (H+) + c (HB-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com