
9、某同学把3克碳放在给定的氧气中充分燃烧,实验数据如下:
|
|
第一次 |
第二次 |
第三次 |
|
给定的O2质量 |
6克 |
8克 |
13克 |
|
生成的CO2质量 |
8.25克 |
11克 |
11克 |
回答:①从以上数据说明,这三次实验中第 次恰好完全反应;
②第 次实验中碳有剩余;剩余 克;
③第 次实验中O2有剩余,剩余 克。
8、在调整好零点的天平两边托盘里,各放质量相同的烧杯,分别盛等溶质质量分数、等质量的稀硫酸,向左边烧杯中加Mg锌,向右边烧杯中加Mg铁,
①若天平保持平衡,则:
a、反应物中一定没有剩余 。
b、一定有剩余的物质 。
c、可能有剩余的物质 。
②若天平失去平衡,则一定是盛放 的托盘下沉。
7、蜡烛燃烧前的质量为ag,燃烧一会儿后质量为bg,生成cgCO2和dg水蒸气,则产物共 g,参与反应的O2的质量g为 g。
6、用锌、氧化铜、稀H2SO4作原料制取铜,有下列两种途径:

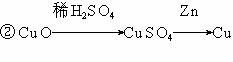
若用这两种方法制取的铜的质量相等时,下列叙述符合实验结果的是
A、消耗相同质量的氧化铜 B、消耗相同质量的锌
C、消耗相同质量的硫酸 D、生成硫酸锌的质量相同
5、将一铁片投入CuSO4溶液中,过一会儿取出,洗净干燥后称量,发现增重6.3克,析出铜( )g
A、50.4 B、6.4
C、2 D、6.3
4、实验室常用MnO2与KClO3共热制氧气,表示混合物中二氧化锰的质量分数随反应时间的变化图象(横坐标表示时间,纵坐标表示混合物中MnO2的质量分数)是()




3、某试管中含有a克氧化铜,通入氢气加热一段时间后停止加热,冷却称量剩余固体质量为b克,则参加反应的氢气的质量为()
A、  B、(a-b)克
B、(a-b)克
C、 D、
D、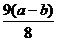
2、下列有关数量关系的判断中错误的是()
A、ag镁和bg氧气恰好完全反应,生成cg氧化镁,则a+b=c
B、mg镁放ng稀硫酸中,充分反应后,溶液为wg,则n﹤w
C、hg铁放人sg硫酸铜溶液中,充分反应后,溶液为eg,则s>e
D、mg氯化钡溶液加入pg硫酸钠溶液中,生成qg溶液,则m+p=q
1、纯净的KClO3和Mn2O2的混合物mg,受热制取O2,完全反应后剩余固体的质量为ng,则反应所得的KCl质量为()
A、ng B、149/64(m-n)g
C、(m-n)g D、149/96(m-n)g
例1.在托盘天平的两盘上,各放一盛有等质量分数足量稀盐酸的烧杯,调节天平至平衡。向左盘烧杯中加入8克氧化镁,若使天平仍然平衡,需向右盘烧杯中加人多少克铝?
解析:由MgO+2HCl=MgCl2+H2O可知,左盘烧杯中增加的质量就是所加的MgO的质量。要使天平仍然平衡,右盘烧杯中物质的质量也应增加8克。而铝会与稀盐酸反应并生成H2逸出,所以加入铝的质量必定大于8克。
例2.某样品为铜和氧化铜的混合物,为测定该样品中氧化铜的含量,取用20克此样品,分四次向其中加入稀盐酸与之充分反应。每次所用盐酸的体积与反应后剩余固体的质量见下表:
|
|
加入稀盐酸的体积/ml |
剩余固体的/g |
|
1 |
40 |
16 |
|
2 |
40 |
12 |
|
3 |
40 |
8 |
|
4 |
40 |
8 |
求:①20g此样品中铜的质量;
②样品中氧化铜的质量分数;
③用氢气充分还原5g此样品可得固体多少克?
解析:根据表格中的数据分析可知第三、四次剩余团体均为8克,说明该剩余固体不能与盐酸反应,这8克固体一定是铜。
例3.为了对海水的氯化物(假设NaCl以计算)进行成分分析。甲、乙、丙三位同学分别进行实验.他们的实验数据如下,请仔细观察分析,回答下列问题。
|
|
甲 |
乙 |
丙 |
|
所取海水样品的质量(g) |
100 |
50 |
50 |
|
加入AgNO3溶液的质量(g) |
50 |
50 |
75 |
|
反应后所得沉淀物的质量(g) |
1.435 |
1.435 |
1.435 |
①两溶液恰好完全反应的是 的实验。
②请计算海水中的氯化物(以氯化钠计算)的质量分数是多少?(结果保留3位有效数字)
解析:根据表中的实验数据,分析可知甲、乙、丙三位同学实验后所得沉淀物的质量相等,则说明三位同学所取的两种反应物的质量至少有一种所取质量正确,全部参加了反应,海水样品乙、丙两同学取质量相同,则说明甲同学取多了。AgNO3溶液的质量甲、乙同学所取相同,则说明丙同学取多了。所以所取溶液恰好完全反应的是乙同学。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com