
2.(1)1nm-100nm w.(2)FeS (3)①H
w.(2)FeS (3)①H H ②2Fe2++H2O2+2H+=2Fe3++2H2O
H ②2Fe2++H2O2+2H+=2Fe3++2H2O
(4)取少量E于试管中,用胶头滴管入NaOH溶液,加热试管,可观察到试管口处湿润的 红色石蕊试纸变蓝
1.⑴第四周期、第Ⅷ族
⑵8Al+3Fe3O4 4Al2O3+9Fe
4Al2O3+9Fe
⑶ 2Al+2OH-+2H2O=2AlO2-+3H2↑
⑷阳极:3O22--6e-=3O2↑;阴极:2Al3++6e-=2Al
(5)①②
13.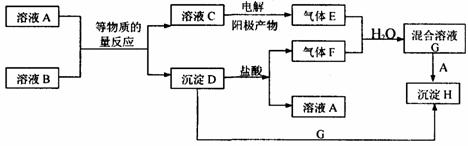 (10分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:
(10分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:
若E和F均为有刺激性气味的气体,H不溶于酸、不溶于水,请填写下列空白。
(1)气体E的化学式为 ,气体F的化学式为 ,C中溶质的化学式为 。
(2)写出下列反应的离子方程式:
C→E ;
D+G→H ;
(3)在混合溶液G中滴人几滴石蕊溶液,可见现象为 ,
原因是 。
无机答案
12.(12分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。

回答下列问题:
(1)P的电子式是_________________;I在元素周期表中的位置是________________;
(2)写出反应①的化学方程式:
_______________________________________________________________;
(3)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的电极反应式:
_______________________________________________________________;
(4)M的水溶液呈___________(填“酸性”“碱性”“中性”),用离子方程式和必要的文字说明原因______________________________________________________________
(5)用惰性电极电解400.00mL A溶液,一段时间内测得溶液pH=1,则需要向溶液中加入___________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。
11、下列A~I九种物质之间的转化关系如图所示,其中部分生成物或反应条件已略去。已知A为固态单质,常温下C、E、F都是无色气体。请填空:

(1)C的固体属于________晶体,F的化学式(分子式)是____________________。
(2)A与B反应的化学方程式是____________________。
(3)G与H反应的离子方程式是____________________,E转变为H和I的离子方程式是______________________。
9. (8分)根据下面物质间转换的框图,回答有关问题:
(8分)根据下面物质间转换的框图,回答有关问题:
(1)写出框图中物质A、B、E、F分别指代物质的化学式:
A. B. E. F.
(2)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积 L;同时反应中转移电子总数是 。(NA表示阿伏加德罗常数)
(3)如果A、B混合气体3.0g(平均摩尔质量15g·mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重 g,并得到O2 mol。
※ 10.(16分)铝是国民经济发展的重要材料,在众多的金属中仅次于钢铁。下图是从铝土矿X中提取其主要成分的两种相互结合的方案示意图。已知A为红褐色沉淀,D、F为白色沉淀,F经失水转化为G,G被誉为信息高速公路的骨架



















(1)结合从铝土矿X中提取其主要成分的两种相互结合的方案回答:
①X的主要成分是________、_______、 (用氧化物的化学式表示)。
②要使X的利用率最高,则方案一与方案二所取矿石的质量比为__________;
用相关的离子方程式来解释确定该质量比的依据_________ 。
(2)自从科学家发明了电解法冶炼铝的方法之后,铝及其合金被广泛地应用。为了测试盛装饮料的易拉罐中铝元素的含量,某实验小组将ag干燥的易拉罐外皮溶解于过量稀硫酸中,测得生成氢气的体积为c L;(该数据为多次平行实验测定结果的平均值,并已换算为标准状况)
① 根据该方案测定的结果计算,易拉罐外皮中铝元素的质量分数为
②若排除实验仪器和操作的影响因素,针对上述方案测定结果的准确性做出判断(用“偏高、偏低、不能确定”表示)并说明理由。___________________________________________
8、(10分)如图所示,甲、乙、丙是三种常见单质,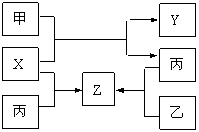 X、Y、Z是常见化合物。它们之间有如下转化关系:
X、Y、Z是常见化合物。它们之间有如下转化关系:
(1)若甲是短周期金属单质,乙、丙是短周期非金属
单质。X、Y、Z中只有一种是离子晶体,试推断:
①含有丙元素的化合物是 (填X、Y、Z)
②X与甲反应的化学方程式 。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常状
况下是深红棕色液体,Y和Z具有相同的阳离子,试推断:
①写出乙、丙的化学式 。
②写出X与足量的甲在溶液中完全反应的离子方程式 。
6.现有物质A-I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(反应中生成的其它物质已略去)

根据上述转化关系图回答:
(1)写出下列物质的化学式X:___________J:_____________
(2)物质H的电子式______________,物质J中的化学键类型有______________
(3)写出反应①的化学方程式__________________________________,
写出反应②的离子方程式___________________________________,
写出反应③的化学方程式____________________________________。
 7、(16分)B是一种人体不可缺少的无色无味的液体;C是一种有磁性的化合物;E是一种无色、无味的有毒气体,是常用的还原剂,根据下列关系图,完成本题:
7、(16分)B是一种人体不可缺少的无色无味的液体;C是一种有磁性的化合物;E是一种无色、无味的有毒气体,是常用的还原剂,根据下列关系图,完成本题:
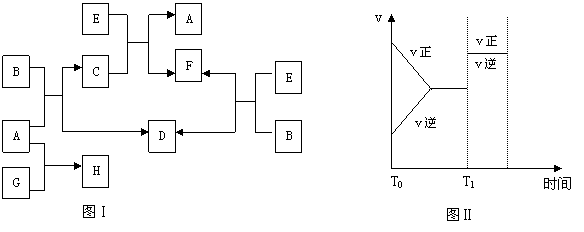
(1)写出B、C的化学式:B ,C
(2)E和N2结构相似,请写出E的化学式:E
 (3)在101千帕和150℃时,可逆反应E+B
F+D反应速率和时间的关系如图Ⅱ所示,那么在T1时速率发生改变的原因可能是:
(填选项)
(3)在101千帕和150℃时,可逆反应E+B
F+D反应速率和时间的关系如图Ⅱ所示,那么在T1时速率发生改变的原因可能是:
(填选项)
|
(4)若G是一种淡黄色固体单质,16克的G和足量的A反放出的热量为Q kJ(Q>0),写出这个反应的热化学方程式:
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出G、I的分子式: , ;H的水溶液呈酸性,请用化学方程式表示呈酸性的原因:
4.下列框图中的每一个字母都是中学化学中常见的物质,所有物质均由短周期元素组成,其中B、C、G、K、L都含有同一种元素。B、E、F、I为单质。常温常压下D为液体,E、F、I为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。这些物质之间有可能发生如下转化,其反应关系如图所示:

(1) 写出E+F→D的化学反应方程式___________________________________。
(2) B的化学式_______, E在I中燃烧的现象为________________________。
(3) 如上图所示,A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为
 ________________________________,_________________________________。
________________________________,_________________________________。
(4)K+G L的离子方程式为____________________________________________
m5.如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应。常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。

请回答下列问题:
(1)写出F的化学式: ;
(2)写出G的电子式: ;
(3)反应①的化学方程式为 ;
人们将反应①所涉及的化学工业称为 ;
(4)反应⑤的离子方程式为 ;
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为
①Na2FeO4具有强氧化性可杀菌消毒,② 
2.中学化学中几种常见物质的转化关系如下:(提示:A有可变价态且与硫反应生成低价态)

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围: 。
(2)B的化学式: 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
。

 3.下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
3.下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
⑴写出B的电子式:____________________。
⑵反应⑤的现象是_____________________________________________。
⑶反应①的化学反应方程式是________________________________________,
在实验室引发反应④的操作是____________________________________。
⑷反应⑥的离子方程式是_________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com