
5、导数的运算法则:(1)常数函数的导数为0,即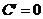 (C为常数); (2)
(C为常数); (2) ,与此有关的如下:
,与此有关的如下: ;(3)若
;(3)若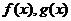 有导数,则①
有导数,则① ;②
;②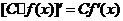 。如(1)已知函数
。如(1)已知函数 的导数为
的导数为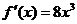 ,则
,则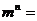 _____(答:
_____(答: );(2)函数
);(2)函数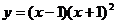 的导数为__________(答:
的导数为__________(答: );(3)若对任意
);(3)若对任意 ,
, ,则
,则 是______(答:
是______(答: )
)
4、导数的几何意义:函数 在点
在点 处的导数的几何意义,就是曲线
处的导数的几何意义,就是曲线 在点
在点 处的切线的斜率,即曲线
处的切线的斜率,即曲线 在点
在点 处的切线的斜率是
处的切线的斜率是 ,相应地切线的方程是
,相应地切线的方程是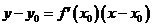 。特别提醒:(1)在求曲线的切线方程时,要注意区分所求切线是曲线上某点处的切线,还是过某点的切线:曲线上某点处的切线只有一条,而过某点的切线不一定只有一条,即使此点在曲线上也不一定只有一条;(2)在求过某一点的切线方程时,要首先判断此点是在曲线上,还是不在曲线上,只有当此点在曲线上时,此点处的切线的斜率才是
。特别提醒:(1)在求曲线的切线方程时,要注意区分所求切线是曲线上某点处的切线,还是过某点的切线:曲线上某点处的切线只有一条,而过某点的切线不一定只有一条,即使此点在曲线上也不一定只有一条;(2)在求过某一点的切线方程时,要首先判断此点是在曲线上,还是不在曲线上,只有当此点在曲线上时,此点处的切线的斜率才是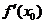 。如(1)P在曲线
。如(1)P在曲线 上移动,在点P处的切线的倾斜角为α,则α的取值范围是______(答:
上移动,在点P处的切线的倾斜角为α,则α的取值范围是______(答: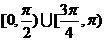 );(2)直线
);(2)直线 是曲线
是曲线 的一条切线,则实数
的一条切线,则实数 的值为_______(答:-3或1);(3)已知函数
的值为_______(答:-3或1);(3)已知函数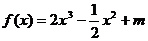 (
(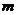 为常数)图象上
为常数)图象上 处的切线与
处的切线与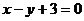 的夹角为
的夹角为 ,则
,则 点的横坐标为_____(答:0或
点的横坐标为_____(答:0或 );(4)曲线
);(4)曲线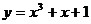 在点
在点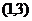 处的切线方程是______________(答:
处的切线方程是______________(答: );(5)已知函数
);(5)已知函数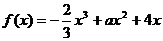 ,又导函数
,又导函数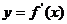 的图象与
的图象与 轴交于
轴交于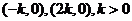 。①求
。①求 的值;②求过点
的值;②求过点 的曲线
的曲线 的切线方程(答:①1;②
的切线方程(答:①1;② 或
或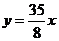 )。
)。
3、求 在
在 处的导数的步骤:(1)求函数的改变量
处的导数的步骤:(1)求函数的改变量 ;(2)求平均变化率
;(2)求平均变化率 ;(3)取极限,得导数
;(3)取极限,得导数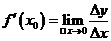 。
。
2、导函数的概念:如果函数 在开区间(a,b)内可导,对于开区间(a,b)内的每一个
在开区间(a,b)内可导,对于开区间(a,b)内的每一个 ,都对应着一个导数
,都对应着一个导数  ,这样
,这样 在开区间(a,b)内构成一个新的函数,这一新的函数叫做
在开区间(a,b)内构成一个新的函数,这一新的函数叫做 在开区间(a,b)内的导函数, 记作
在开区间(a,b)内的导函数, 记作 
 ,导函数也简称为导数。
,导函数也简称为导数。
1、导数的背景:(1)切线的斜率;(2)瞬时速度;(3)边际成本。 如一物体的运动方程是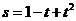 ,其中
,其中 的单位是米,
的单位是米, 的单位是秒,那么物体在
的单位是秒,那么物体在 时的瞬时速度为_____(答:5米/秒)
时的瞬时速度为_____(答:5米/秒)
1.将5.6gMg、Cu组成的混合物投入到适量的硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原为NO和NO2),若向反应后的溶液中加入过量的NaOH溶液,待金属离子完全沉淀后,再将沉淀过滤、洗净、干燥后称得质量为10.7g,则收集到的气体体积V值可能是( )
A、1.12 B、5.34 C、6.72 D、8.32
课后训练
1 在传统的硝化法制硫酸中,其关键反应为NO2+SO2=NO+SO3,2NO+O2=2NO2,SO3+H2O=H2SO4。据此,对有关物质氧化性的相对强弱顺序判断正确的是( )
A、H2SO4> NO2> O2 B、O2> SO3> H2SO4 C、NO2> O2> SO3 D、O2> NO2> SO3
2 自然界存在NaIO3,可利用NaIO3与NaHSO3溶液来制取单质碘。反应分两步进行:IO3-+3HSO3-=I-+3SO42-+3H+;IO3-+5I-+6H+=3I2+3H2O。下列说法错误的是( )
A、NaIO3是氧化剂,HSO3-是还原剂 B、HSO3-的还原性比I-弱
C、I2既是氧化产物又是还原产物 D、生产中可得到副产物H2SO4和Na2SO4
3 在实验室中可利用氧化还原反应制取的气体是( )
①HCl ②NH3 ③O2 ④CO2 ⑤Cl2 ⑥NO
A、①③④ B、②⑤⑥ C、③④⑤ D、③⑤⑥
4 已知A2On2-可与B2-反应,B2-被氧化为B单质,A2On2-被还原为A3+,若100mL0.3mol·L-1的A2On2-溶液,与150mL0.6mol·L-1的B2-溶液恰好完全反应,则n的值为( )
A、5 B、6 C、7 D、8
5 反应NO+O2+NO2+H2O→HNO3是多组化学计量数的化学方程式,当氧气有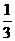 被NO还原时,此方程式各物质的化学计量数依次为( )
被NO还原时,此方程式各物质的化学计量数依次为( )
A、4、9、24、14、28 B、1、1、1、1、2 C、8、9、12、10、20 D、任意比均可
6 将Mg、Cu组成的26.4g混合物投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的4mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是( )
A、43.2g B、46.8g C、53.6g D、63.8g
答案、1 :B 1 – 6: D、B、D、C、A、B
2010年浙江省高考化学易错题强化训练
热点八 离子反应
1 下列反应的离子方程式错误的是( )
A、向碳酸氢钙溶液中加入少量的氢氧化钠溶液 Ca2++2HCO3- +2OH - =CaCO3↓+CO32-+2H2O
B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C、氢氧化铝与足量氢氧化钠溶液反应 Al(OH)3+OH-=AlO2-+2H2O
D、乙酸溶液与氢氧化钠溶液混合 OH-+H+=H2O
2 有下列物质,正盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、硝酸、醋酸、稀硫酸。在水溶液中符合离子方程式:2H++SO32-=SO2↑+H2O的化学反应的组合共有( )
A、6个 B、9个 C、12个 D、15个
3 铝和镓(Ga)的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界中镓极少量分散于铝土矿(如Al2O3)中。用NaOH溶液处理铝土矿时,生成NaAlO2、NaGaO2;而后向溶液中通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应的原因是( )
A、H3GaO3的酸性强于H3AlO3 B、H3AlO3的酸性强于H3GaO3
C、Ga3+浓度小,所以不沉淀 D、NaGaO2 比NaAlO2易溶于水
4 下列离子中,最易结合质子的是( )
A、Cl- B、CH3CH2O - C、OH - D、C6H5O –
5 若溶液中由水电离产生的c(H+)=1×10 -13mol·L -1,满足此条件的溶液中一定可以大量共存的离子组是( )
A、Al3+、Na+、NO3-、Cl- B、K+、Na+、Cl -、SO42-
C、K+、Na+、Cl-、CO32- D、K+、I -、NO3-、Cl -
6 已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度的下列关系中(R表示S或C),一定正确的是( )
A、c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) B、c(Na+)+ c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C、c(H+)+ c(H2RO3)=c(RO32-)+c(OH-) D、两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
7 某同学测得物质的量浓度均为0.01mol·L-1的醋酸和醋酸钠的混合溶液呈酸性后,得出下列关系式,你认为不正确的是( )
A、c(CH3COO -)>c(CH3COOH) B、c(CH3COO -)>c(Na+)>c(H+)>c(OH -)
C、c(Na+)=c(CH3COO -)=0.01mol·L-1 D、c(CH3COOH)+c(CH3COO -)=0.02mol·L-1
8 0.1 mol·L-1的NH4HSO4溶液与0.1mol·L-1的NaOH溶液等体积混合,下列关于混合后溶液中离子浓度关系的表述正确的是( )
A、c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH -)
B、c(Na+)=c(SO42-)>c(NH4+)> c(OH -)> c(H+)
C、c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH -)
D、c(Na+)=c(SO42-)=c(NH4+)>c(H+)>c(OH -)
9 关于某溶液中所含离子的推断,不正确的是( )
①加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl – 存在
②加入NaOH溶液,有白色沉淀,NaOH过量时沉淀不消失,可确定有Mg2+存在
③加入BaCl2溶液,有白色沉淀,加盐酸或稀硝酸沉淀均不溶解,可确定有SO42- 存在
④加入盐酸,有能使澄清石灰水变浑浊的无味气体产生,可确定溶液中有CO32- 存在
A、①③ B、②④ C、①②③ D、①②③④
答案、1 – 9:AD、A、A、B 、B、C、C、C、D
2010年浙江省高考化学易错题强化训练
热点九 电解质溶液
1 在相同温度时,100 mL0.01 mol·L-1的醋酸溶液与10 mL0.1 mol·L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A、H+的物质的量 B、醋酸的电离程度
C、中和时需NaOH的量 D、醋酸的物质的量
2 常温下,某硫酸溶液pH=a,某NaOH溶液的pH=b,已知a+b=12,两溶液混合后的pH=7,则酸溶液的体积V(酸)和碱溶液的体积V(碱)的关系正确的是( )
A、V(酸)=102V(碱) B、V(碱)=102V(酸) C、V(酸)=2V(碱) D、V(碱)=2V(酸)
3 依据下列实验,不能证明一元酸HR是弱酸的是( )
A、室温下NaR溶液的pH大于7 B、加热NaR溶液时,溶液的pH变小
C、稀盐酸中加入少量NaR固体,溶解后溶液的pH变大
D、HR溶液中加入少量NaR固体,溶解后溶液的pH变大
4 在一定体积某浓度的Ba(NO3)2溶液中,逐滴加入pH=1的稀硫酸至Ba2+ 完全沉淀时,溶液的pH=2,若忽略溶液混合时的体积变化,则稀硫酸与Ba(NO3)2溶液的体积比是( )
A、10∶1 B、1∶9 C、1∶10 D、9∶1
5 已知酸式盐NaHB在水溶液中存在下列反应:①NaHB=Na++HB - ②HB – H++B2-
H++B2-
③HB -
+H2O H2B+OH
- ,且溶液中c(H+)>c(OH -),下列说法中一定正确的是( )
H2B+OH
- ,且溶液中c(H+)>c(OH -),下列说法中一定正确的是( )
A、NaHB为强电解质 B、H2B为强酸
C、H2B为弱电解质 D、HB –的电离程度小于HB –的水解程度
6 用已知物质的量浓度的NaOH溶液测定未知物质的量浓度的盐酸,无论是酸往碱中滴还是碱往酸中滴,在其它操作正确的前提下,下列操作一定会使测定结果偏高的是( )
A、酸式滴定管未用待测盐酸润洗 B、碱式滴定管未用标准碱液润洗
C、滴定过程中不慎有液滴溅出 D、滴定前仰视读数,滴定后平视读数
7 现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合,最终所得的溶液( )
A、一定呈酸性 B、可能呈碱性 C、可能呈中性 D、一定呈中性
8 广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法不正确的是( )
A、CaO2的水解产物是H2O2和Ca(OH)2 B、Ca2C3的水解产物之一是C3H4
C、SiCl4的水解产物之一是SiH4 D、Na3N的水解产物是两种碱
答案、1 – 8:AB、B、B、B、AC、B、BC、C
2010年浙江省高考化学易错题强化训练
热点十 化学反应速率与化学平衡
 1 可逆反应mX(g)+nY(g)
1 可逆反应mX(g)+nY(g) pZ(g)在一定条件下的一密闭容器中达到平衡后,t'时只改变某一外界条件,化学反应速率(v)---时间(t)的图像如右图所示。则下列说法中正确的是( )
pZ(g)在一定条件下的一密闭容器中达到平衡后,t'时只改变某一外界条件,化学反应速率(v)---时间(t)的图像如右图所示。则下列说法中正确的是( )
A、若m+n=p,则t'时只能是增大了容器内的压强
B、若m+n=p,则t'时可能是升高了温度
C、若m+n>p,则t'时可能是扩大了容器的容积
D、若m+n<p,则t'时只能是加入了催化剂
2 某恒温恒容的容器中,反应2A(g) B(g)建立了平衡。若再向容器中通入一定量的A气体或B气体,重新达到平衡后,有关容器内A、B的体积分数说法正确的是( )
B(g)建立了平衡。若再向容器中通入一定量的A气体或B气体,重新达到平衡后,有关容器内A、B的体积分数说法正确的是( )
A、气体A的体积分数比原平衡时大,气体B的体积分数比原平衡时小
B、气体A的体积分数比原平衡时小,气体B的体积分数比原平衡时大
 C、气体A、B的体积分数都比原平衡时小
C、气体A、B的体积分数都比原平衡时小
D、气体A、B的体积分数都比原平衡时大
3 右图表示某反应在一段时间内,当其它条件不变时,改变某一反应条件对反应物转化率的影响。t1→t2为升高温度,t2→t3为增大压强,符合此图像的反应是( )
A、N2(g)+3H2(g) 2NH3(g);△H<0 B、ClF(g)+F2(g)
2NH3(g);△H<0 B、ClF(g)+F2(g) 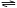 ClF3(g);△H<0
ClF3(g);△H<0
 C、N2O3(g)
C、N2O3(g) 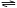 NO2(g)+NO(g);△H>0 D、N2(g)+O2(g)
NO2(g)+NO(g);△H>0 D、N2(g)+O2(g) 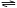 2NO2(g);△H>0
2NO2(g);△H>0
4 如右图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY,此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) 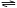 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法错误的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法错误的是( )
A、反应速率:v(B)>v(A) B、A 容器中X的转化率为80%
C、平衡时的压强:2p(A)=p(B) D、平衡时Y的体积分数:A>B
5 可逆反应3A(g)
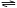 3B+C;△H>0,随着温度的升高,气体的平均摩尔质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断中,错误的是( )
3B+C;△H>0,随着温度的升高,气体的平均摩尔质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断中,错误的是( )
A、B和C可能都是气体 B、若C为固体,则B为气体
C、B和C一定都是气体 D、有可能B为固体,C为气体
6 一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) 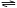 zC(g)。达平衡后,测得A的浓度为0.5mol·L-1。恒温下将密闭容器的体积扩大为原来的两倍,再次达到平衡后,测得A的浓度为0.3mol·L-1。则下列说法中,错误的是( )
zC(g)。达平衡后,测得A的浓度为0.5mol·L-1。恒温下将密闭容器的体积扩大为原来的两倍,再次达到平衡后,测得A的浓度为0.3mol·L-1。则下列说法中,错误的是( )
A、扩容后平衡向左移动 B、扩容后,B的转化率减小
C、x+y>z D、扩容后,C的体积分数增大
7 T℃时,在一恒定容积的容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g)
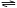 xC(g),达到平衡后,容器中气体的压强为p,C的体积分数为a。若在T℃、压强为p时,按0.6mol的A、0.3mol的B、1.4mol的C为起始物质,达到平衡后,C的体积分数仍为a,则x的值可能为( )
xC(g),达到平衡后,容器中气体的压强为p,C的体积分数为a。若在T℃、压强为p时,按0.6mol的A、0.3mol的B、1.4mol的C为起始物质,达到平衡后,C的体积分数仍为a,则x的值可能为( )
A、2 B、3 C、4 D、无法确定
答案、1 – 7:D、B、D、CD、C、D、AB
]2010年浙江省高考化学易错题强化训练
热点十一 原子结构、分子结构和晶体结构
1  是我国最近合成的一种新核素,
是我国最近合成的一种新核素, 表示的磷原子是( )
表示的磷原子是( )
A、核外有25个电子,其中5个能参与成键 B、 是一种新元素
是一种新元素
C、核内有15个质子,核外有10个电子
D、质量数为25,原子序数为15,核内有10个中子
2 短周期元素A、B不属于同主族,形成的化合物化学式为AB,若A的原子序数为n,则B的原子序数不可能为( )
A、n+1 B、n+2 C、n+3 D、n+4
3 下列有关主族元素形成的离子的叙述正确的是( )
A、单核阳离子的电子层结构(除氢外)一定与上一周期稀有气体原子电子层结构相同
B、单核阳离子的电子层数一定比其原子的电子层数少
C、单核阴离子的半径一定比其原子半径大
D、除H – 外,单核阴离子最外层一定是8电子结构
4 ABn型分子中,若A原子的最外层未达到稳定结构,则该分子被称为缺电子分子。下列分子属于缺电子分子的是( )
A、CO2 B、BeCl2 C、BF3 D、PCl5
5 A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法中正确的是( )
A、A和M的原子序数之差为8 B、A和M原子的电子总数之和可能是11
C、A和M原子的最外层电子数之和为8 D、A和M原子的最外层电子数之差为7
6 下列物质分离的过程中涉及共价键断裂的是( )
A、用碱液除去溴苯中的溴 B、用饱和食盐水洗去Cl2中的少量HCl
C、用CCl4萃取碘水中的碘 D、用升华法除去碘中混有的少量NaCl
7 甲烷分子中的4个氢原子都可以被取代。若甲烷分子中的4个氢原子分别被苯基和氯原子取代,可得到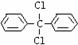 ,对该分子的描述,正确的是( )
,对该分子的描述,正确的是( )
A、此分子的同分异构体中一定同时含有两个 B、所有碳原子可能都在同一平面上
B、所有碳原子可能都在同一平面上
C、此分子属极性分子 D、此分子属芳香烃类物质
8 由下列各组的三种元素构成的化合物中,既有离子晶体,又有分子晶体的是( )
A、H、O、C B、Na、S、O C、H、N、O D、H、S、O
9 下列有关共价化合物的说法中,一定正确的是( )
①具有较低的熔、沸点 ②不是电解质 ③固体时是分子晶体 ④都由分子构成 ⑤液态时不导电
A、①③④ B、②④⑤ C、①②③④⑤ D、只有⑤
答案、1 – 9:D、C、CD、BC、B、AB、C、C、D
2010年浙江省高考化学易错题强化训练
热点十二 元素周期律 元素周期表
1 根据元素性质递变规律,下列判断正确的是( )
A、酸性:HClO4>HBrO4>HIO4;碱性:NaOH>KOH>RbOH
B、沸点:Cl2<Br2<I2;熔点:Na<K<Rb
C、可燃性:H2O<NH3<CH4;还原性:HCl<H2S<PH3
D、还原性:Na>Mg>Al;氧化性:P>S>Cl2
2 下列事实中,能说明氯的非金属性比硫强的是( )
A、高氯酸的酸性比硫酸强 B、次氯酸的氧化性比稀硫酸强
C、氯化氢比硫化氢的热稳定性好 D、氯原子最外层电子数比硫原子多
3 A、B、C为短周期元素,已知A、B处于同一周期;A、C的最低价离子分别为A2 - 和C- ,A2 – 的离子半径大于C -,B2+与C –具有相同的电子层结构,以下叙述中不正确的是( )
A、原子半径A>B>C B、原子序数A>B>C
C、离子半径A2->C->B2+ D、最外层电子数C>A>B
 4 甲、乙为短周期元素的单质,丙、丁为氧化物,它们存在如右图的关系,下列各组的甲、乙一定符合的是( )
4 甲、乙为短周期元素的单质,丙、丁为氧化物,它们存在如右图的关系,下列各组的甲、乙一定符合的是( )
A、钠和氢 B、氧和硫 C、碳和硅 D、铝和铁
答案、1 – 4:C、AC、A、C
2010年浙江省高考化学易错题强化训练
热点十三 典型物质的性质
1 下列有关氯气的叙述中,正确的是( )
A、工业上常用MnO2和与浓盐酸共热来制取
B、1molCl2与热NaOH溶液反应生成NaClO3和NaCl时,需NaOH 2 mol
C、Cl2与过量铁反应时生成FeCl2
D、Cl2能使碘的淀粉溶液褪色,说明Cl2有还原性
2 下列有关硫酸的叙述,正确的是( )
A、用稀硫酸作乙酸和乙醇酯化的催化剂
B、用浓硫酸作乙醇制乙烯的催化剂和脱水剂
C、含2molH2SO4的浓硫酸可与1molCu完全反应
D、1 mol·L-1和18 mol·L-1的硫酸各20mL,加足量的铝,后者产生的氢气多
3 对下列事实的解释正确的是( )
A、浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B、不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性
C、足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
D、锌与稀硝酸反应得不到氢气,说明稀硝酸能使锌钝化
4 下列有关NaOH的叙述中,正确的是( )
A、可用瓷坩埚熔化氢氧化钠
B、工业上用电解饱和食盐水的方法制取氢氧化钠
C、跟氢氧化钠溶液反应的有机物一定是酸或酚
D、只用酚酞试液就可检验碳酸钠溶液中是否混有氢氧化钠
5 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装了盛有Na2O2(或K2O2)颗粒的装置,它的用途是产生氧气。下列有关Na2O2的叙述正确的是( )
A、Na2O2中阴、阳离子的个数比是1∶1
B、Na2O2分别与水及CO2反应产生相同量氧气时,需水和CO2的质量相等
C、Na2O2的漂白原理与SO2的漂白原理相同
D、与CO2、H2O反应产生等量氧气,转移电子数相同,耗Na2O2的质量相同
6 下列有关铝及其化合物的叙述正确的是( )
A、铝粉与氧化镁共热可制取金属镁
B、足量铝分别与含1molHCl、1molNaOH的溶液反应,产生相同量的氢气
C、工业上用电解熔融Al2O3的方法冶炼铝
D、在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化
7 某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为( )
A、11.2g B、16.8g C、19.6g D、22.4g
答案、1 – 6:B、B、A、B、D、C、D
2010年浙江省高考化学易错题强化训练
热点十四 有机化学知识
1 按反应物与产物的结构关系,有机反应大致可分为:取代反应、消去反应、加成反应三种类型,下列反应属于加成反应的是( )
A、C6H5CH2Cl+NaCN→C6H5CH2CN+NaCl B、C6H5Li+CO2→C6H5COOLi
C、CH3CH2CHO+HCN→CH3CH2CH(CN)OH D、CH3COOC2H5→CH3COOH+C2H4
2 我国纳米专家发明的“WXP复合纳米材料”的主要化学成分是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用,“WXP复合纳米材料”有望用于制造纸币。试推断以直链戊二醛(OHCCH2CH2CH2CHO)为母体的氨基二氯代戊二醛的可能结构有( )
A、6种 B、7种 C、8种 D、10种
3 1-丙醇的蒸气和空气混合,通过灼热的铜网生成一种有机物,和该有机物互为同分异构体的是( )
A、
 B、
B、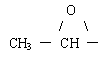
 C、
C、
|
 D、
D、
|

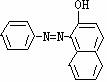 4 苏丹红是一种工业染料,存在多种形式,有致癌作用,禁止作为食品添加剂。右图为苏丹红一号的结构简式。据此推测:
4 苏丹红是一种工业染料,存在多种形式,有致癌作用,禁止作为食品添加剂。右图为苏丹红一号的结构简式。据此推测:
(1)下列说法错误的是( )
A、可看作醇 B、可看作芳香烃
C、可看作酚 D、分子式是C16H12N2O
(2)它不可能有的化学性质是( )
A、与NaOH溶液反应 B、与浓硫酸发生磺化反应
C、与Br2发生取代反应 D、能发生银镜反应
5 2004年诺贝尔化学奖授予以色列科学家Aaron Cichanover Avram Hershko和美国科学家Irwin Rose,以表彰他们发现并在分子水平上认识细胞是怎样调控细胞内某些蛋白质作为靶分子,并在特定时间和特定场所被分解的。蛋白质的这种分解过程是发生了( )
A、酯化反应 B、加聚反应 C、水解反应 D、缩聚反应
6 甲醛是装饰材料中常见的有害物质,会污染环境。已知甲醛分子中4个原子是共平面的,下列分子中所有原子不可能共平面的是( )
A、 B、
B、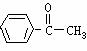 C、
C、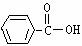 D、
D、
7 将一定量的有机物A溶于烧碱溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液红色变浅,再向其中加入盐酸,显酸性,并析出白色晶体;取少量上述晶体放到FeCl3溶液中,溶液呈紫色。则有机物A可能是( )
A、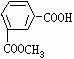 B、
B、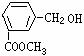 C、
C、 D、
D、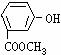
8 有机物分子中原子(或原子团)间的相互影响导致它们化学性质的改变。下列叙述不能说明上述观点的是( )
A、苯酚能与氢氧化钠溶液反应,而乙醇不能
B、乙醛分子中甲基氢比乙烷分子中的氢更易被卤原子取代
C、乙烯可发生加成反应,而乙烷不能
D、相等物质的量的甘油和乙醇分别与足量钠反应,甘油产生的氢气多
9 卫生部发出公告,提醒人们慎食油炸薯条,因为其中含有剧毒的丙烯酰胺。已知乙酰胺的结构简式为CH3CONH2,苯甲酰胺的结构简式为C6H5CONH2,则丙烯酰胺的结构简式为( )
A、CH3CH2CONH2 B、CH3CH2COONH4 C、CH2=CHCONH2 D、CH2=CHCONH4
10 最近研制出一种新材料 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染。下列关于聚乳酸的说法中正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染。下列关于聚乳酸的说法中正确的是( )
A、聚乳酸是一种纯净物 B、聚乳酸的单体是乳酸
C、聚乳酸的相对分子质量是乳酸的n倍 D、聚乳酸降解时与水发生加成反应
答案、1 – 10:BC、C、BD、(AB、D)、C、B、D、CD、C、B
2010年浙江省高考化学易错题强化训练
热点十五 化学实验
1 下列有关物质存放的叙述中,正确的是( )
A、实验室将少量钠保存在无水乙醇中 B、工业上将冷的浓硫酸存放于敞口铝制容器中
C、实验室将少量白磷保存在二硫化碳中 D、工业上将干燥氯气液化后存放于钢瓶中
2 下列有关实验的叙述,正确的是( )
A、不小心把浓硫酸沾到皮肤上,立刻用用稀氨水洗涤
B、直接点燃制得的氢气不会有危险 C、实验室制乙烯时,烧瓶中要加碎瓷片
D、排水法收集由氯酸钾分解制得的氧气,当集气瓶中充满氧气后立即停止加热
3 下列各组物质仅用水就能鉴别的是( )
①NO2和Br2蒸气 ②硝基苯和苯 ③固体CaO和KNO3 ④浓硫酸和稀硫酸
⑤固体碳酸钠和碳酸氢钠
A、①②④ B、②③⑤ C、①③④ D、①②③④⑤
4 用盐酸、氨水、苛性钠溶液中的任一种作试剂,均可鉴别的一组是( )
A、硝酸银和氯化铝 B、氯化亚铁和硫酸亚铁 C、氯化镁和硝酸铵 D、氯化钠和碳酸钠
 5 右图为实验室制氢气的装置。若液面刚好不与锌粒接触而又无酸液,则可以从长颈漏斗中加入的试剂是( )
5 右图为实验室制氢气的装置。若液面刚好不与锌粒接触而又无酸液,则可以从长颈漏斗中加入的试剂是( )
A、食盐水 B、KNO3溶液 C、苯 D、Na2CO3溶液
6 只用滴管和试管,不用其它试剂就可区别的溶液是( )
A、0.2 mol·L-1CaCl2溶液和0.2 mol·L-1Na2CO3溶液
B、0.1 mol·L-1H2SO4溶液和饱和Na2CO3溶液
C、0.2 mol·L-1Ba(OH)2溶液和饱和NaHCO3溶液
D、0.1 mol·L-1NaAlO2溶液和0.3 mol·L-1盐酸
7 下列实验不能达到预期目的的是( )
|
|
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯与溴的非金属性强弱 |
|
B |
测Na2CO3和Na2SO4溶液的pH |
比较硫与碳的非金属性强弱 |
|
C |
AlCl3溶液、MgCl2溶液中分别通过量氨气 |
比较镁和铝的金属性 |
|
D |
测同浓度的盐酸和某一元酸溶液的导电性 |
比较盐酸和该一元酸的酸性强弱 |
答案、1 –7:D、C、D、A、A、BD、C
2010年浙江省高考化学易错题强化训练
热点十六 化学与生产、生活的结合
1 下列使用化学物质处理食品的方法中,正确的是( )
A、用工业酒精兑白酒 B、腌制食品中添加的NaNO2应严格控制用量
C、用NaHCO3焙制糕点 D、用“福尔马林”溶液浸泡海参、鱿鱼等海产品
2 从化学角度分析,下列叙述中,错误的是( )
A、大量使用含磷洗衣粉可导致水体富营养化
B、向燃煤中加入生石灰,可减少对大气的污染
C、HgCl2的稀溶液可用于手术器械的消毒,原因是其可使蛋白质凝固
D、氟里昂或氮的氧化物都可破坏臭氧层,而导致“温室效应”
3 下列变化中,不一定是化学变化的是( )
A、金属腐蚀 B、食品发酵 C、物体爆炸 D、橡胶老化
4 从化学角度分析,生活中的下列做法不正确的是( )
A、用沸水泡加酶洗衣粉 B、长期保存食用油应隔绝空气
C、使用加碘(KIO3)食盐时避免高温 D、禁止在装饰材料中添加甲醛、苯等有害物质
5 下列有关工业生产硫酸的说法,正确的是( )
A、接触法制硫酸可用石膏作原料 B、接触法制硫酸最后得到的是50%的稀硫酸
C、SO2转化成SO3是在高温高压有催化剂的条件下进行
D、SO2转化成SO3时放出的热量通过热交换得到利用
答案、1 –5:BC、D、C、A、D
1.一定温度下,某饱和碳酸钠溶液中碳酸钠的质量分数为w%,加入ag无水碳酸钠可析出bg碳酸钠晶体(Na2CO3·10H2O),则溶液中溶质质量减少 ( )
A.(b-a)g B.(b-a)×wg C.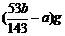 D.(b-a)×w%g
D.(b-a)×w%g
课后训练
1 在一定温度下,将一包白色的无水硫酸铜粉未投入15g水中充分搅拌后过滤,得到一定质量的蓝色晶体和8.4 g滤液,若此温度下无水硫酸铜的溶解度为40 g,则这包无水硫酸铜的质量是( )
A、18.4g B、9.0g C、16.0g D、6.6g
2 下列有关胶体的说法中,正确的是( )
A、胶体都是均匀透明的液体
B、电泳现象能证明胶体粒子比溶液中溶质微粒直径大
C、丁达尔现象可以鉴别胶体和溶液
D、纳米材料的粒子直径一般从几纳米至几十纳米(1 nm=10-9 m),因此纳米 材料是胶体
3 相对分子质量为M的气态化合物V L(标准状况)溶于m g水中,得到的溶液的浓度为a%或c mol·L-1,密度为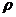 g·cm-3,下列各式中错误的是( )
g·cm-3,下列各式中错误的是( )
A、 B、
B、
C、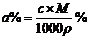 D、
D、
4 已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
|
溶质的质量分数 |
甲溶液密度╱g·cm-3 |
乙溶液密度╱g·cm-3 |
|
1% |
0.95 |
1.02 |
|
5% |
0.92 |
1.04 |
|
9% |
0.90 |
1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是( )
A、混合后,甲、乙溶液中溶质的质量分数均大于5%
B、混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
C、混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
D、混合后,甲、乙溶液中溶质的质量分数均等于5%
答案、1 :CD 1 – 4:A、C、C、B
2010年浙江省高考化学易错题强化训练
热点七 氧化还原反应
课堂训练
8.铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480 mL 的NO2气体和336 mL的N2O4气体(均为标准状况下),在反应后的溶液中加入足量的NaOH溶液,生成的沉淀的质量为 ( )
A.7.04g B.8.26g C.8.51g D.9.02g
答案:1C2C3B 1D2A3A4D5C6A7D8C
2010年浙江省高考化学易错题强化训练
热点六 分散系
课堂训练
7.在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体672mL,.将此盛有混合气体的试管倒立在盛有水的水槽中,然后通入一定体积的O2恰好使气体完全溶解于水中,则通入O2的体积为 ( )
A.504mL B.168mL C.224mL D.336mL
6.某浓度的硝酸与过量铁粉反应时生成了4.48L 气体(标准状况下),若改与铝反应(生成NO气体),则最后可溶解的铝的质量是 ( )
气体(标准状况下),若改与铝反应(生成NO气体),则最后可溶解的铝的质量是 ( )
A.13.5g B.9g C.27g D.8.9g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com