
9.答案: C
[解析] A. 1mol 金属钠含有的电子数为11NA,而含有的最外层电子数为1NA;B. 标准状况下苯为液态;C. 0.012kg12C所含的原子数为NA;D. 硫酸分子式为H2SO4,电离时H2SO4=2H++SO42-。因此,所含H+数应为2NA
8.答案:BC
[解析]Fe过量可使Fe3+还原为Fe2+,A错误。3NO2+H2O==2HNO3+NO,易知B正确。C中, 可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果。3Fe+4H2O===Fe3O4+4H2↑,由方程可知D错误。
7.答案:A
[解析]m(Al):m(NaOH)=27:40;
m(Al(OH)3):m(NaOH)=75:40;
m(AlCl3):m(NaOH)=33.375:40;
m(Al2O3):m(NaOH)=51:40;
所以相同质量的物质,消耗碱量最多的是Al。故选A。
6.答案:D
[考点]本题考查了物质的量的相关计算。
[解析]本题的解题关键是将溶液分成两份,即每份体积为a/2 L
,n(Ba2+)=n (H2SO4)=xmol,n(Cl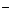 )=n( AgNO3)=ymol,根据电荷守恒
)=n( AgNO3)=ymol,根据电荷守恒
2x[Ba2+]+[Na+]=[Cl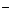 ],在同一溶液中得:2 x n(Ba2+)
+n(Na+)=n(Cl
],在同一溶液中得:2 x n(Ba2+)
+n(Na+)=n(Cl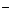 )。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a 。
)。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a 。
5.答案:B
[考点]本题考查了阿伏加德罗定律及其应用。
[解析]由PV=nRT可知:气体的体积在温度、压强一定时,体积与物质的量成正比;当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小。 所以A、D错;B正确;只有标况下气体摩尔体积才近似为22.4L/mol。
4.答案:C
[解析]2 mol重水含有2NA个D2O分子,故A选项错误;1 g氢气的物质的量为mol,因此含有有NA个H2分子,B选项错误;2 mol钠在反应中失去2mol电子,因此在反应中得到1mol,故C选项正确;水为液态,22.4 L水也不是1mol,故D选项错误。
3.答案:A
[解析]解题时要注意回忆概念、分析原理注意运算公式的适用范围。B选项4.6gNO2气体中理论上含有1mol NO2分子,约6.02×1023个NO2分子,由于2NO2
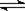 N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
2.答案:B
[解析]根据题意可以知道,铁粉完全反应且反应前后固体的质量不变,因此设参加反应的CuSO4与H2SO4的物质的量分别为x和y,则:
Fe + CuSO4 = FeSO4+Cu △m
1mol 56g
x 56 x g·mol-1
Fe + H2SO4 = FeSO4+H2↑ △m
1mol 8g
y 8 y g·mol-1
因反应前后固体的质量没有发生变化,因此第一个反应质量的减小等于第二个反应质量的增加,即56x g·mol-1=8 y g·mol-1,所以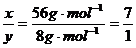 。
。
1.答案:C
[解析]Cl2作为氧化剂时化合价有0价降低为-1价,而Cl2是双原子分子,因此1 mol
Cl2作为氧化剂得到的电子数应为2NA,故A选项错误;在标准状况(0℃、101kPa)时,22.4L氢气的物质的量的1mol,其中含有的H原子的物质的量为2mol,即含有2NA个氢原子,故B选项错误;14g氮气中含有的电子的物质的量为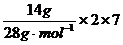 =7mol,即电子数为7NA个,所以C选项正确;NA个一氧化碳分子的物质的量为1mol,其质量为28g,0.5 mol 甲烷的质量为0.5 mol × 16 g·mol-1=8g,所以而的质量比为28g︰8g=7︰2,因此D选项错误。
=7mol,即电子数为7NA个,所以C选项正确;NA个一氧化碳分子的物质的量为1mol,其质量为28g,0.5 mol 甲烷的质量为0.5 mol × 16 g·mol-1=8g,所以而的质量比为28g︰8g=7︰2,因此D选项错误。
19.(09年山东理综·10)下列关于氯的说法正确的是 ( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若35 17Cl、37 17若Cl为不同的核素,有不同的化学性质 学科
学科
C.实验室制备Cl2,可用排放和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
20 .(09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值) ( )
.(09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值) ( )
 A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
 B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
 C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
 D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
21 .(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:( )
.(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:( )


 A.+1 B.+2 C.+3 D.+4
A.+1 B.+2 C.+3 D.+4
高考真题答案与解析
[考点1] 物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com