
11.(14分)在一定温度下,将2molA和2molB两种气体混合于2L密闭容器中,发生反应
3A(g)+B(g) C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L。由此推断:
C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L。由此推断:
(1)x值等于_____________________。
(2)B的平衡浓度为_____________________。
(3)A的转化率为___________。
(4)用D表示的平均反应速率为_____________。
(5)如果缩小体积(温度不变),该体系中混合气体的密度_____________,平均相对分子质量_______________(填“增大”或“减小”或“不变”)。
(6)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入______________mol B物质。
10.(14分)甲、乙、丙、丁、戊为五种短周期主族元素,且原子序数依次增大。甲与丁、丙与戊分别同主族,戊的原子最外层电子数比次外层少2个。甲与乙可以按照原子个数比3:1形成化合物A,且每个A分子中含有10个电子。
请回答:
(1)戊的原子结构示意图是_____________,乙单质分子的电子式是___________。
(2)A溶于水所得溶液呈碱性的原因是(用电离方程式表示)______________________。
(3)甲与丁形成的离子化合物能与H 2O反应得到强碱溶液和H 2,写出该反应的化学方程式_____________________________。在该反应中,氧化剂与还原剂的物质的量之比是_______________________________。
(4)X、Y、Z为三种强电解质,分别由上述五种元素中的三种组成。X、Y、Z的稀溶液之间存在如下转化关系:

①用离子方程式表示Y溶液呈酸性的原因是_______________________________;
②金属Cu与X、Y的混合溶液反应的离子方程式是:_________________________。
9.(15分)用如下图所示装置可以完成一系列实验(图中夹持装置已略去)

请回答下列问题:I.(1)若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
|
B中棉花的位置 |
① |
② |
③ |
④ |
|
所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
|
现象 |
|
|
褪色 |
黄色 |
|
体现SO 2的性质 |
水溶液显酸性 |
漂白性 |
|
氧化性 |
(2)写出③中反应的离子方程式:______________________________________。
Ⅱ.若用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。
(1)仪器p中盛装试剂的化学式为_______________________。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:
_____________________________________________________________________.
①处包有的某固体物质可能是(填序号)_____________________________________。
a.MnO 2 b.KMnO4 c.KCl d.Cu
(3)在实验过程中,在③处能观察到__________________________________________。
(4)反应较长时间后,②处棕黄色褪去,生成无色的 ,写出该反应的离子方程式:
,写出该反应的离子方程式:
_________________________________________________________________。
8.在K2CO3样品中含Na2CO3、KNO3、Ba(NO3) 2中的一或两种杂质。将13.8 g该样品溶于足量水中得到澄清溶液,再加入过量CaCl2溶液,可得9.0 g沉淀,则原样品中含有的杂质会是
A.肯定有Na2CO3,没有Ba(NO3)2
B.肯定没有Na2CO3,Ba(NO3)2
C.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
D.无法判断何种为肯定或否定的杂质
第Ⅱ卷(非选择题·60分)
7.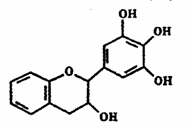 茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如右图所示。关于EGC的下列叙述中不正确的是
茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如右图所示。关于EGC的下列叙述中不正确的是
A.分子中所有的原子共面
B.遇FeCl3溶液发生显色反应
C.1molEGC能与3molNaOH完全反应
D.易发生氧化反应和取代反应,难发生加成反应
6.下列说法正确的是
A.测定HCI和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
B.在101KPa时,l molH2完全燃烧生成液态水,放出285.8 kJ热量,H2燃烧热为
-285.8kJ/mol
C.在101 KPa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热量,则
C的燃烧热为110.5 kJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3lKJ/mol,若将含 0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
5.某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++2S(CuFeS2中S为-2价)。下列说法正确的是
A.反应中,CuFeS2既作氧化剂又作还原剂
B.氧化产物是S,还原产物是Fe2+和Cu2+
C.氧化剂的氧化性Fe3+>Fe2+>Cu2+
D.当转移1mol电子时,有46gCuFeS2参加反应
4. 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关
说法中,不正确的是
A.此过程中铜并不被腐蚀
B.此过程中电子从Fe移向Cu
C.正极电极反应式为:2H++2e-=H2↑
D.此过程中还涉及到反应: 4Fe(OH) 2+2H2O+O2=4Fe(OH)3
3.25℃时,浓度为0.2 mol/L的Na2CO3溶液中,下列判断不正确的是
A.加热,c(OH-)增大 B.存在七种粒子
C.存在水解平衡,不存在电离平衡
D.加入NaOH固体,恢复到原温度,c( )增大
)增大
2.Fe3+、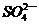 、
、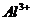 和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,则X可能是
和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,则X可能是
A.Na+
B.OH-
C. D.Cl-
D.Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com