
26、 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)= mol,
V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体
积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:
。
广东省深圳高级中学09-10学年高一上学期期末考试
化学答案及评分标准
客观题:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
D |
A |
B |
D |
C |
C |
C |
A |
D |
D |
C |
|
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
A |
D |
C |
B |
BC |
AC |
CD |
AB |
AD |
AD |
|
25、下图中A-J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。

根据图示回答问题:
(1)写出B D G J H所代表物质的化学式:B D G
J H
(2)反应②的化学方程式是 ;
(3)J与盐酸反应的离子方程式是 ;
24、(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。制备方法有:① 湿法:次氯酸盐氧化法 ② 干法:高温过氧化物法。
(1)湿法制备的的主要反应方程式如下:在空格中填写适当物质,并配平反应化学方程式。
Fe(OH)3 + NaClO+ → Na2FeO4 + NaCl + H2O
(2)干法制备中牵涉到的物质有:FeSO4、Na2FeO4、Na2SO4、Na2O2
则发生氧化反应的过程是: → (填化学式)
(3)制备相同质量Na2FeO4时转移的电子数:,湿法制备 干法制备(填〝>〞或〝<〞或〝=〞)。
(4)干法制备中一定要在密闭的容器中进行,原因是 。
(5)高铁酸钾和二氧化氯都是高效杀菌消毒剂,但消毒效率(单位质量转移的电子数)是
不相同的,则高铁酸钾的效率是二氧化氯的 倍。(结果保留一位小数)
22、化学是一门以实验为基础的自然科学,正确搭配、选择、识别各种实验装置,是基本的化学素养之一。请按要求完成下列五小题。
(1)右下图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
 A.大理石和稀硫酸制取二氧化碳
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.双氧水和二氧化锰混合制氧气
D.铝片与NaOH溶液制氢气
(2)指出(不必改正)下面3个实验中各存在的一个错误:
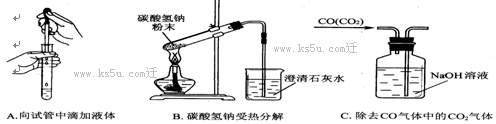
A___________________,B_____________________,C____________________
(3)如下图是实验室配制1mol/L的碳酸钠溶液的操作顺序图,请用每个操作所代表的字母做正确实验排序___________________________________________________。


(4)某同学用CCl4萃取碘水中的碘并实现与水层的分离。
其实验进行到如图所示一步,用字母对应进行的操作排序:
A 待下层液体流尽后,更换烧杯;
B 将分液漏斗颈上的玻璃塞打开;
C 将上层液体从上口倒出;
D使下层液体沿烧杯壁流下;
E 再将分液漏斗下面的活塞拧开;
正确的操作顺序是
(5)某同学为测定一定质量的钠与水反应产生H2体积,设计了下图装置进行实验。(固定装置省略)己知有关物质的密度ρ(K):0.86g/cm3 、ρ(Na): 0.97g/cm3 、ρ(煤油):0.8g/cm3。
 ①
实验初始,用手按住胶塞,拔下大头针,则试管中能观察到的现象是_____ ___
①
实验初始,用手按住胶塞,拔下大头针,则试管中能观察到的现象是_____ ___
A Na在煤油层和水层交界处上下振荡;
B Na始终停留在煤油层;
C Na始终停留在水层
D Na表面有气泡
E Na变小至消失。
② 如果将钠换成相同大小的钾进行上述实验,结果钾反应完所用的时间比钠反应完所用的时间______(填“长”或“短”)
21、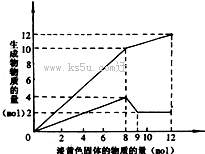
 已知:NH4+ + OH- = NH3 + H2O 。现某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。则下列说法正确的是(
)
已知:NH4+ + OH- = NH3 + H2O 。现某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。则下列说法正确的是(
)
A 该溶液中一定不含Fe2+、Cu2+;一定含NH4+。
B 该溶液中Mg2+、Al3+的物质的量浓度之比为5:2 。
C 上述过程中产生的气体为氨气。
D 上述加入的淡黄色固体应为Na2O2 。
第Ⅱ卷(共52分)
20、实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:4CuI+Hg=Cu2HgI4+2Cu。以下有关说法正确的是( )
A.上述反应的产物Cu2HgI4中,Hg的化合价为+2
B.上述反应中CuI既是氧化剂,又是还原剂
C.上述反应中Hg与Cu均发生氧化反应
D.上述反应中生成 64g Cu时,转移的电子数为6.02×1023
19、下列两种气体的分子数一定相等的是( )
A. 质量相等、密度不等的N2和C2H4 B. 等体积等密度的CO2和N2O
C. 等温等体积的O2和N2 D. 等压等体积的N2和CO2
18、下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是 ( )
|
|
A |
B |
C |
D |
|
试样 |
Na2CO3 (
NaHCO3) |
FeCl2 (FeCl3
) |
Fe(Al
) |
CO2 (SO2
) |
|
除杂试剂 |
澄清石灰水 |
NaOH 溶液 |
NaOH 溶液 |
饱和NaHCO3 |
17、右图是某同学欲验证NaHCO3和Na2CO3热稳定性而设计的实验装置(加持装置省略),则下列说法正确的是( )
A 实验进行时甲变浑浊;
B 实验进行时乙变浑浊;
C 该实验装置设计有缺陷,不能达到其实验目的。
D 为避免烫伤,实验结束时应先熄灭酒精灯,待冷却后再将甲乙移开。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com