
22、(16)Ⅰ. 下面a-e是中学化学实验中常见的几种定量仪器:
a、量筒 b、容量瓶 c、滴定管 d、托盘天平 e、温度计
①使用容量瓶的第一步操作是___________________________________。
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是烧杯_________。
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________。
④若用上述仪器进行中和滴定,则缺少的仪器是__________。
Ⅱ 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
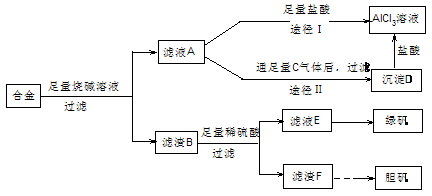
试回答下列问题:
⑴用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是
。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是 ,理由是
。
(3)从滤液E中得到绿矾晶体的实验操作是 。
(4)写出用滤渣F制备胆矾晶体的有关化学方程式
。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是 。
21.(10)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
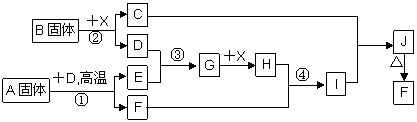
(1)G的化学式为 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
20、(10)(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发生如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
该反应常用于检验Mn2+的存在。其特征现象是_______________________,
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2SO4- Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
19、(10)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42- 、SiO32- 、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是______________,肯定不存在的离子是____________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
①H++OH-=H2O ②
③ ④HCO3-+H+=H2O+CO2 ⑤
18、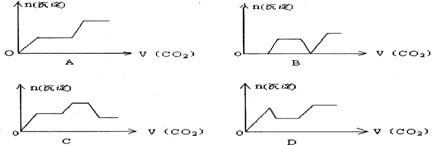 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示 C
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示 C
第Ⅱ卷(非选择题 共46分)
17、在密闭容器中,反应X2(g)+Y2(g)
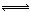 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
A.图Ⅰ是加入适当催化剂的变化情B.图Ⅱ是扩大容器体积的变化情况
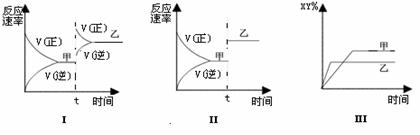 C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
16、某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四组实验:
① 将镁粉投入冷水中,未见任何现象;
② 将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③ 将镁粉放入液溴中,未观察到任何明显现象;
④ 向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应 B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到 D.镁粉在水的催化下与溴发生反应
15.我国锑的蕴藏量占世界第一。提取单质锑一般是先在高温下将硫化物转为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS……①
Sb4O6+6C=4Sb+6CO………………②关于反应①、反应②的说法正确的是( )
A.反应①②中的氧化剂分别是Sb2S3. Sb4O6
B.反应①中每生成3mol FeS 时,共转移6mol 电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4molSb时,反应①与反应②中还原剂的物质的量之比为 4∶3
14、关于反应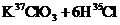

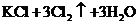 的有关叙述中,正确的是( )
的有关叙述中,正确的是( )
A.KCl中含有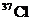 B.KCl中含有
B.KCl中含有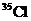
C.生成物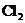 的相对分子质量大于71 D.该反应转移电子数为
的相对分子质量大于71 D.该反应转移电子数为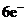
13.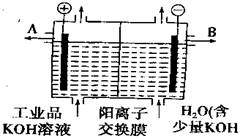 氢氧化钾是重要的工业产品,工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜电解提纯,电解槽内装有阳离子交换膜(只允许阳离子通过),其工业原理如下图所示:下列有关说法中错误的是(
)
氢氧化钾是重要的工业产品,工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜电解提纯,电解槽内装有阳离子交换膜(只允许阳离子通过),其工业原理如下图所示:下列有关说法中错误的是(
)
A.该电解槽的阳极反应式为4OH--4e-=2H2O+O2↑
B.通电开始后,阴极附近溶液的PH会增大
C.K+可从阳极区进入阴极区和OH-组成KOH
D.除去杂质后的KOH溶液从液体出口A导出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com