
28.(4分)
⑴ C ⑵ A 、B
⑶ 2H2 + O2  2H2O
2H2O
⑷ 在化学反应中,分子可分,原子不可分(答案合理给分)
27.(8分)
⑴ 失 +3 Al2O3 ⑵ B
⑶ Fe(或铁) Fe + CuSO4 = FeSO4 + Cu
H2SO4 (或稀硫酸) Fe + H2SO4 = FeSO4 + H2↑
26.(7分)
⑴ 物理 过滤 ⑵ 铁(或铁) ⑶ 水 脂肪 糖类 ⑷ B、D、F
|
⑴谷氨酸钠的相对分子质量为_______。
⑵谷氨酸钠中氢元素与氧元素的质量比为 。
⑶该味精每包含钠元素的质量为_______g
(计算结果精确到0.1)。
35.(3分)某化学兴趣小组为测定某大理石样品中碳酸钙的含量,将适量的稀盐酸加入到20 g大理石中(其它成分不与盐酸反应),再将产生的CO2气体用足量的澄清石灰水吸收,同时测量2分钟内石灰水增加的质量,结果如下表所示:
|
时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
|
石灰水增加的质量/g |
0 |
3.0 |
5.0 |
6.0 |
6.6 |
6.6 |
6.6 |
⑴共产生二氧化碳气体 g。
⑵计算大理石样品中碳酸钙的质量分数。(写出计算过程)
东城区2009--2010学年度第一学期期末教学目标检测
初三化学试卷答案及评分参考
33.(7分)草酸的化学式为H2C2O4,甲、乙两同学对草酸受热分解及其产物的检验做了探究:
[猜想与假设]猜想一:分解产物是 CO2、H2O
猜想二:分解产物是CO、 H2O
猜想三:分解产物是CO2、CO
猜想四:分解产物是CO2、CO和H2O
以上猜想中,不可能的是猜想 ,原因是 。
[查阅资料]⑴无水硫酸铜遇水由白色变成蓝色
⑵碱石灰(CaO和NaOH的混合物)是一种常用的干燥剂
⑶草酸晶体熔点较低,加热到182℃即可以熔化成液体
[实验设计]甲同学设计了A装置,乙同学设计了B装置。
 (注:①图中铁架台略去 ②B中所用容器为底部弯曲的试管)
(注:①图中铁架台略去 ②B中所用容器为底部弯曲的试管)
|
|
[实验过程]
⑴甲同学按A装置实验。在给草酸晶体加热时,先均匀加热,然后固定在试管底部加热,过一会儿观察到澄清石灰水变浑浊。
⑵乙同学按B装置实验。观察到无水硫酸铜由白色 变成蓝色,澄清的石灰水变浑浊,且生成的气体通过碱石灰后,在干燥管的尖嘴处点燃,该气体能燃烧。通过进一步检验,燃烧的气体为CO。乙同学验证燃烧气体为CO的实验操作与现象是 。
变成蓝色,澄清的石灰水变浑浊,且生成的气体通过碱石灰后,在干燥管的尖嘴处点燃,该气体能燃烧。通过进一步检验,燃烧的气体为CO。乙同学验证燃烧气体为CO的实验操作与现象是 。
[实验结论] 猜想 是正确的,请写出草酸受热分解的化学方程式 。
[反思与评价]
经过实验和讨论,同学们认为乙同学的设计是比较科学合理的。请你对比两套装置,指出B装置的两条优点是 。
32.(5分)根据下图所示有关物质性质的实验,回答以下问题。

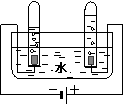

A B C
⑴装置A中,正极与负极产生气体的体积比为 。
⑵装置B中的现象:铁丝在氧气中剧烈燃烧, ,放出大量的热,生成黑色固体。
⑶装置C中, 由现象①说明铜能够 ;对比现象①②说明物质燃烧需要 ;对比现象①③说明两种可燃物的 不 同。
同。
31. (7分)下图是实验室中用于制取和收集气体的装置图,请回答以下问题:
(7分)下图是实验室中用于制取和收集气体的装置图,请回答以下问题:
⑴写出上图中带标号仪器的名称:①_____,②_____。
⑵用高锰酸钾制取氧气,发生装置选择_____(填字母序号,下同),反应的化学方程式为______,
⑶实验室制取二氧化碳,应选用的固体药品是_______,收集装置选择______。
 ⑷右图是某同学放置在桌面上的一瓶初中常见
⑷右图是某同学放置在桌面上的一瓶初中常见 的无色纯净气体,你如何用实验方法来确定该瓶中盛放的是哪种气体
(写出一种方法即可) ?
的无色纯净气体,你如何用实验方法来确定该瓶中盛放的是哪种气体
(写出一种方法即可) ?
30.(5分) 甲、乙、丙、丁均为初中化学常见物质,它们有如右下图的转化关系,请回答:
 ⑴若甲和乙反应生成的丙为最清洁的气体燃料,则丙的化学式为 ;
⑴若甲和乙反应生成的丙为最清洁的气体燃料,则丙的化学式为 ;
其中甲是常见金属,则此化学反应的基本类型为  。
。
⑵若乙是能够支持燃烧的气体,请写出在一定条件下符合此转化关系的一个化学方程式 。
⑶若甲是极易与血红蛋白结合的有毒气体,丙是我国春秋战国时期就开始生产和使用的一种金属,工业上冶炼该金属的化学方程式为________。
⑷若甲为气体,并能与乙的溶液反应生成白色沉淀。则下列说法正确的是  (填字母序号)。
(填字母序号)。
A.此反应一定有水生成
B.甲是由两种元素组成的物质
C.因为反应后有沉淀生成,所以生成物的总质量减小
D.若丙为氧化物,则参与反应的甲和反应体系中丙的分子个数比为1:1
29.(6分)高纯硅是制造计算机电路芯片的主要原料。请 回答:
回答:
⑴硅元素属于 (填“金属”或“非金属”)元素,在地壳中硅元素的含量仅次于__ ___元素。
___元素。
⑵硅在氧气中燃烧生成二氧化硅,并放出大量的热,可作未来新能源,该反应的基本类型为 。
⑶工业上用石英(主要成分为SiO2)制备粗硅的反应为:SiO2+2C Si+2R↑,则R的化学式为 ,反应后硅元素的化合价 (填写“升高”或“降低”)。
Si+2R↑,则R的化学式为 ,反应后硅元素的化合价 (填写“升高”或“降低”)。
⑷生产高纯硅可用三氯硅烷(SiHCl3)。三氯硅烷在空气中极易燃烧,燃烧时可观察到有红色火焰和白色烟,生成物为二氧化硅、氯化氢和氯气,此反应的化学方程式为 。
28.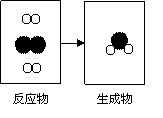

 (4分)右图是密闭体系中某反应的微观示意图,“ ”和“
”
(4分)右图是密闭体系中某反应的微观示意图,“ ”和“
”
分别表示不同原子。
请用下列粒子的字母序号回答⑴、⑵两个小题:


 A.
B.
C.
A.
B.
C.
⑴依据质量守恒定律,反应后方框内应再填入一个 粒子。
⑵该反应中的物质属于单质的有 。
⑶符合该微观示意图的一个具体反应的化学方程式为 。
⑷由此反应可知分子与原子主要不同之处是(答出一点即可) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com