
3、理解元素概念时的注意事项
(1)元素是以核电荷数(即质子数)为标准对原子分类。只论种类,不讲个数。
(2)质子数是划分元素种类的标准。质子数相同的原子和单核离子都属同一种元素。如Na+与Na都属钠元素,但Na+与NH4+不属于同一种元素。
(3)同种元素可以有不同的存在状态。如单质中和化合物中。
(4)同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
(5)自然界中目前已知的元素有112种,可分为金属元素、非金属元素、稀有气体元素。
2、理解元素的概念应把握“同质子,类原子”六个字。
(1)“同质子”即指元素的种类是由核电荷数(即核内质子数)决定的,与原子中的中子数、电子数无关。同种元素原子的质子数一定相同,不同种元素的原子的质子数一定不相同。
(2)“类原子”是指一种元素可能不止一种原子。它包括质子数相同、中子数不同的原子(如:氢元素有三种原子:氕、氘、氚,它们的质子数相同,但中子数不同);也包括质子数相同,而电子数不同的原子和离子(如:铁原子通常有三种存在形式即Fe、Fe2+、Fe3+,它们都属于铁元素)。
1、元素的概念
元素是指具有相同核电荷数(即质子数)的同一类原子的总称。例如:氯
O +1 +3
+5 +7
元素包括C1-、Cl、Cl、C1、Cl、Cl…不同形式的粒子和Cl一35、Cl一37(指相对原子质量分别为35和37的两种氯原子)等粒子,因为它们的核电荷数均为17。
3、(2009·潍坊)下表呈现的是部分元素的原子结构示意图、主要化合价等信息。


下列叙述错误的是( )
A.铝原子结构示意图的最外层有3个电子
B.元素的正化合价数一定等于原子的最外层电子数
C.核电荷数分别为8和14的元素,组成化合物的化学式为SiO2
D.同一周期中,原子的核外电子层数相同,最外层电子数从左向右逐渐增多
2、(2009·泰州)结构示意图 表示的微粒是( )

A.原子 B.分子 C.阳离子 D.阴离子
1、(2009·晋江)夏日的校园,百花盛开,阵阵花香,沁人心脾。花香四溢的现象说明( )
A.分子是不断运动的
B.分子是由原子构成的
 C.分子具有一定的质量
D.分子之间有一定的间隔
C.分子具有一定的质量
D.分子之间有一定的间隔
3、离子与原子的区别
|
项目 |
原子 |
阳离子 |
阴离子 |
|
结构 |
核电荷数=质子数=电子数 |
核电荷数=质子数>电子数 |
核电荷数=质子数<电子数 |
|
电性 |
中性 |
带正电荷 |
带负电荷 |
|
性质 |
一般性质比较活泼(除稀有气体原子外) |
稳定 |
稳定 |
|
符号(举例) |
H、O、Al |
H+ Al3+ |
O2- Cl- |
[例1](2008·盐城)下列对分子、原子、离子的认识,正确的是( )
A、分子是保持物质的最小粒子 B、原子是最小的粒子,不可再分
C、原子得到或失去电子后形成离子
D、CO2和CO性质的差异主要是由于分子间的间隔不同
[答案]C
[解析]分子是保持物质化学性质的最小粒子,不能保持物质的物理性质,故A错。原子是化学变化中最小的粒,它由原子核和电子构成,所以B错。原子得到电子带负电,失去电子带正电,形成离子,所以C正确。CO2和CO性质的差异是因为分子结构不同,所以D错。
[规律小结]分子、原子和离子都可以直接构成物质,分子有原子构成,原子得失电子形成离子,不同种分子,性质不同
变式训练一
2、原子与分子的区别和联系
|
|
分子 |
原子 |
备注 |
|
相似点 |
质量和体积都很小,处于不断的运动中,分子间有间隔。同种分子化学性质相同,不同种分子化学性质不同 |
质量和体积都很小,处于不断的运动中,原子间有间隔,同种原子性质相同,不同种原子性质不同 |
同种原子具有相同的核电荷数。分子与构成这种分子的原子比较,原子比分子小,但并不是所有的原子都一定比分子小(不同种分子和原子无法比较) |
|
不同点 |
在化学反应中,分子本身发生分裂,可以再分 |
原子是化学变化中的最小粒子,在化学反应中不可再分;在化学反应前后,原子的种类和数目不发生改变 |
|
|
联系 |
分子是原子构成的,分子是构成物质的一种粒子 |
原子是构成分子的粒子,原子也是构成物质的一种粒子 |
1、物质构成的体系
 概念:保持物质化学性质的最小微粒
概念:保持物质化学性质的最小微粒
 分子
体积和质量都很小
分子
体积和质量都很小

 特征 分子间有一定的间隔
特征 分子间有一定的间隔
构 构
分子在不停的运动
 成 成
概念:化学变化中的最小微粒
成 成
概念:化学变化中的最小微粒
特征:同分子的特征相似

 物质
原子
质子(带正电)
物质
原子
质子(带正电)


 构成 得
原子核(带正电)
构成 得
原子核(带正电)
失 结构
中子(不带电)
构
电
核外电子(带负电)
成 子
形
 成 概念:带电的原子或原子团
成 概念:带电的原子或原子团
 离子
阳离子
离子
阳离子
分类
阴离子
3. (18分)如图所示的竖直平面内有范围足够大、水平向左的匀强电场,在虚线的左侧有垂直纸面向里的匀强磁场,磁感应强度大小为B,一绝缘弯杆由两段直杆和一段半径为R的半圆环组成,固定在纸面所在的竖直平面内,PQ、MN水平且足够长,半圆环PAM在磁场边界左侧,P、M点在磁场边界线上,NMAP段是光滑的,现有一质量为m,带电+q的小环套在MN杆上,它所受电场力为重力的
(18分)如图所示的竖直平面内有范围足够大、水平向左的匀强电场,在虚线的左侧有垂直纸面向里的匀强磁场,磁感应强度大小为B,一绝缘弯杆由两段直杆和一段半径为R的半圆环组成,固定在纸面所在的竖直平面内,PQ、MN水平且足够长,半圆环PAM在磁场边界左侧,P、M点在磁场边界线上,NMAP段是光滑的,现有一质量为m,带电+q的小环套在MN杆上,它所受电场力为重力的 倍,当在M右侧D点由静止释放小环时,小环刚好能达到P点。
倍,当在M右侧D点由静止释放小环时,小环刚好能达到P点。
(1)求DM间距离x0;
(2)求上述过程中小环第一次通过与O等高的A点时弯杆对小环作用力的大小;
(3)若小环与PQ间动摩擦因数为μ(设最大静摩擦力与滑动摩擦力大小相等且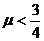 ),现将小环移至M点右侧4R处由静止开始释放,求小环在整个运动过程中克服摩擦力所做的功。
),现将小环移至M点右侧4R处由静止开始释放,求小环在整个运动过程中克服摩擦力所做的功。
解:(1)因小球刚好能到达P点,则vP=0
由动能定理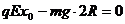 …………………………………………………3分
…………………………………………………3分
又 解得
解得 …………………………………………………2分
…………………………………………………2分
(2)在小球由D点到A点的过程中,由动能定理
 ………………………………………………………3分
………………………………………………………3分
解得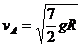
又 …………………………………………………………2分
…………………………………………………………2分
解得 ……………………………………………………2分
……………………………………………………2分
(3)小球最终做往复运动,且在P点的速率为0,由动能定理
 …………………………………………………………4分
…………………………………………………………4分
解得 …………………………………………………………………………2分
…………………………………………………………………………2分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com