
23. (8分)氧化锌和锌的混合物14.6 g,加入浓度为1 mol/L的盐酸500 mL,充分反应后,所得溶液中Zn2+的物质的量浓度为0.4 mol/L,求:
(1)原混合物中氧化锌和锌的物质的量。
(2)反应后溶液中剩余氢离子浓度(假设反应前后溶液体积不变)
凤阳新世纪高考补习学校月考检测
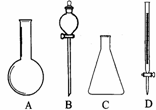
22.(9分)(1)有右下图所示A、B、C、D四种仪器:
请选择下列仪器名称的序号,填入相应的空格内:
①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管 A __B_________C__________D___________
 (2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是_______,烧杯的实际质量为_____g.
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是_______,烧杯的实际质量为_____g.
(3)实验室欲配置250mL0.2mol/L的NaOH溶液,需用托盘天平称取 g溶质,实验仪器除托盘天平、量筒外,还需要 。
21. (6分)配平氧化还原反应方程式: (1)( )C2O42-+( )MnO4-+( )H+= ( )CO2+( )Mn2++( )H2O
(2)( )Fe(OH)3+( )ClO-+( )OH- ===( )FeO42-+( )Cl-+( )H2O
 (3)( )(NH4)2SO4===( )SO2+( )H2O+( )N2+( )NH3
(3)( )(NH4)2SO4===( )SO2+( )H2O+( )N2+( )NH3
20. (10分)复印机工作时易产生臭氧,臭氧浓度过高时,对人体有害。臭氧具有强氧化性,可以使湿润的碘化钾淀粉试纸变蓝,其中臭氧部分转化为氧气。 (1)写出并配平发生反应的离子方程式 ; (2)该反应的氧化剂是 ,还原产物是 ; (3)该反应包含两种反应:①氧化反应为 转化 ,②还原反应过程的反应式 。 (4)反应中1mol臭氧参加反应时 (填“得到”或“失去”) mol电子。
19. (13分)A、B、C、D是四种可溶于水的化合物,分别有阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH-、CO32-、NO3-、SO42-两两组合而成,它们的溶液发生如下反应:
①A与B 反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。
②B与C 反应生成白色沉淀E和气体H;③C与D 反应生成有色沉淀F和气体H。
(1)分别写出它们的化学式:
A B C D E F H
(2)写出①中再加过量A沉淀量减少的离子方程式:
(3) 胶体F是一种常用的化学物质,写出制备胶体F的离子方程式: ;提纯胶体F的方法: ;如果用胶体F做电泳实验, 极附近颜色加深。
18.电解500mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是
A.0.10 mol/L Ag+ B.0.20 mol/L Zn2+
C.0.20 mol/L Cu2+ D.0.20 mol/L Pb2+?
17.(09年福建理综·6)下列类型的反应,一定发生电子转移的是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
16. (2006东城一考)一定质量的铜和足量的硝酸反应,所放出的气体与标准状况下的氧气1.12L混合后再通入水中,恰好被完全吸收,则铜的质量为
A.3.2g B.4.8g C.6.4g D.10.8g
15. (09年海南化学·7)用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是:
A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
14. (09年广东化学·17)常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+下列说法正确的是
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程可以加入适量Fe2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com