
1.《中国古代官僚政治制度研究》一书中指出:(汉代)最基层的官吏要把诏书抄写在乡亭的墙壁上,后来改为书写在木板上,或直接以“扁书”(成编的简册)悬挂在市里乡亭。这种现象说明汉朝时
A.郡县制在全国范围内全面推行 B.皇帝直接对人民进行统治
C.基层官吏直接对皇帝负责 D.皇帝通过政令的贯彻来控制地方
25.(6分)实验室里需用480mL1.0mol/L的NaOH溶液,下图是某学生在实验室配制该NaOH溶液的过程示意图。请你回答有关问题。
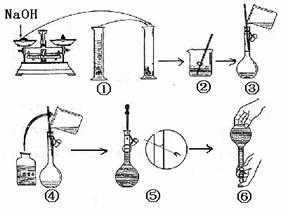
①用已知质量为25.6g的表面皿,准确称取NaOH固体。则应在托盘天平的右盘上放置砝码的质量是 (最小的砝码质量为1.0g),然后将游码移至标尺的 处,在左盘的表面皿中加入NaOH固体,小心加NaOH至天平平衡;
②观察配制NaOH溶液的过程示意图,指出其中有错误的是(填操作序号) ;如果配制过程中没有等到溶液冷却到室温,则配制所得溶液的浓度将 (填“偏高”“偏低”“不变”);
③在上述实验过程中,用到的容量瓶的规格是 。
24.(7分)某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1535 |
|
沸点(℃) |
2467 |
2750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?
(填“合理”或“不合理”)。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:
。
(3)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝。请填写下列表格:
|
所用试剂 |
|
|
实验操作及现象 |
|
|
有关反应的化学方程式 |
|
23.(8分)实验室用浓盐酸和二氧化锰共热制取氯气,现要制取一瓶干燥纯净的氯气,并防止剩余氯气逸出污染空气。现有下列仪器和药品可供使用:
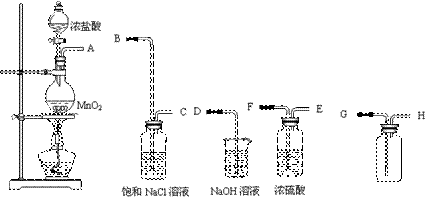
⑴写出实验室用浓盐酸和二氧化锰制取氯气的化学反应方程式:
___________________________________ _;
⑵连接上述仪器的正确顺序是(填各接口处的字母)
A接_____,_____接_____,_____接______,_______接_______。
⑶气体尾气吸收装置中反应的化学方程式为___________________ 。
⑷在装置中,a.饱和食盐水的作用是________________________;
b.浓硫酸的作用是____________________________;
22.(8分)目前世界上60%的镁是从海水中提取的。工业“从海水中提取镁”的流程图如下:
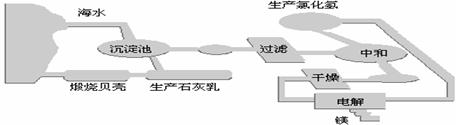
⑴写出下列各步骤的化学反应方程式或离子方程式:
①煅烧海边大量的贝壳成石灰,并将石灰制成石灰乳(化学方程式);
、 ;
②将石灰乳加入到海水沉淀池中得Mg(OH)2沉淀;
③过滤得Mg(OH)2沉淀并加盐酸得MgCl2溶液(离子方程式);
,再经蒸发、结晶得到MgCl2·6H2O;
④将MgCl2·6H2O在HCl气流下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg。
⑵上述方法提镁的过程中,在降低成本、减少污染方面做了一些工作,其采取的措施有:
① ②
21.(6分)形成酸雨的原理之一可简示如下: 含硫燃料 硫酸。回答下列问题:
(1)A物质的化学式_________,B物质的化学式_________;
(2)三个反应中不属于氧化还原反应的是反应_________(填序号);
(3)SO2中硫元素显+4价,它可能降低到0价,利用这一性质可在工厂的烟道气中通入合适的___________(填“氧化剂”或“还原剂”)除去SO2,达到减小污染的目的。
(4)火力发电厂燃煤中含大量的硫,其排出的废气往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明:高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于造高烟囱的结果,地面浓度降低了30%之多。你认为减少酸雨产生的途径可采取的措施是__________。
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫
D.把工厂迁到农村 E.开发新能源
20. 两种金属粉末混合物13g,投入足量的稀硫酸中,在标准状况下产生11.2L气体,则这种混合物可能是
A. Zn和Cu B.Fe和 Zn C.Al和Fe D.Mg和Cu
龙岗区2009-2010学年第一学期期末学业评价试题
高一化学
第Ⅱ卷 (非选择题,共35分)
19.下列选项中,反应后溶液的导电能力比反应前明显增强的是
A.向100mL 1mol/L盐酸溶液中加入4g NaOH固体
B.向100mL 1mol/L的醋酸溶液中通适量NH3气体
C.向饱和和澄清石灰水中通少量CO2气体
D.通足量的氯气于亚硫酸溶液中
18.将铜粉放入稀硫酸中,加热无明显现象发生。但加入某盐后,发现铜粉质量逐渐减少,则该盐可能是
A.Fe2(SO4)3 B.ZnSO4 C.KNO3 D.NaCl
17.某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
|
|
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物)/g |
9.2 |
15.7 |
27.6 |
 (标况)/L (标况)/L |
2.24 |
3.36 |
3.36 |
A.盐酸的物质的量浓度为3.0mol·L-1
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.15.7g混合物恰好与50mL盐酸完全反应
D.在50mL盐酸中加入9.2g混合物时混合物全部反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com