
20.(10分)由C、Cu、FeCO3、铜锈[主要成分为Cu2(OH)2CO3]组成的固体混合物,进行了如下所示的实验过程:

回答下列问题:
(1)无色气体1的成分是: 。
(2)混合物乙中加入NaNO3后,反应的离子方程式是:
 。
。
(3)溶液X中含有的金属阳离子是 。
(4)无色气体3的成分是: ;检验无色气体3成分的实验方案是:
。
19.(10分)化合物A由两种不同短周期元素X、Y组成,具有良好电绝缘性。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为
。
(2)0.1 mol/L X的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离 子
子
方程式为
(3)Y的单质在放电条件下能与氧气反应。写出化学方程式:
 。
。
(4)化合物A能与水缓 慢反应生成含Y的化合物Z,Z分子中含有10个电子。写出该
慢反应生成含Y的化合物Z,Z分子中含有10个电子。写出该
反应的化学方程式: 。
(5)工业用X的单质和化合物Z在高于1700K反应制备A。已知该反应可以认为是置
换反应,该反应的化学方程式是 。
18.(10分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g) ΔH2
CH3OH(g) +
H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
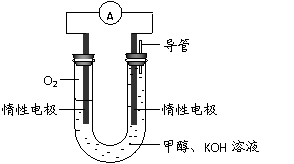 (3)某实验小组依据甲醇燃烧的反应原理,
(3)某实验小组依据甲醇燃烧的反应原理,
设计如右图所示的电池装置。
① 该电池正极的电极反应为
。
② 工作一段时间后,测得溶液的
pH减小,该电池总反应的化学方程式为
。
17.(14分) 已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+) • c(OH-)=___________
(2)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(3)各取5mL上述溶液,分别加热到90℃,pH较小的是________溶液
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液_ _______;NH4Cl溶液__________
_______;NH4Cl溶液__________
(5)取5mL NH4Cl溶液,加水稀释至50mL,c(H+) 10-6mol·L-1(填“>”、“< ”或“=”),c(NH4+)/c(H+)
(填“增大”、“减小”或“不变”)
”或“=”),c(NH4+)/c(H+)
(填“增大”、“减小”或“不变”)
16.某无色溶液中只可能含有①Na+ 、②Ba2+、 ③Cl-、 ④Br-、⑤SO32-、⑥SO42- 离子中的若干种(忽略水电离出的H+、OH),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
|
步骤 |
操作 |
现象 |
|
(1) |
用pH试纸检验 |
溶液的pH大于7 |
|
(2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
(3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
(4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是③④⑤ B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是③⑥
II卷(共60分)
15.用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示。则下列说法正确的是
 A.构成原电池时b极反应为: Cu﹣2e-=Cu2+
A.构成原电池时b极反应为: Cu﹣2e-=Cu2+
B.构成电解池时a极质量一定减少
C.构成电解池时b 极质量可能减少也可能 增加
增加
D.构成的原电池或电解池工作后就可能产生大量气体
14. 可逆反应 2SO2 (g)+O2 (g) 2SO3 (g); △H<0在一定条件下达到平衡状态。时间为t1时改变条件,化学反应速率与反应时间关系如图。下列说法中正确的是
可逆反应 2SO2 (g)+O2 (g) 2SO3 (g); △H<0在一定条件下达到平衡状态。时间为t1时改变条件,化学反应速率与反应时间关系如图。下列说法中正确的是
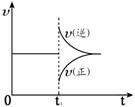 A.维持温度、反应体系体积不变,t1时充入SO3(g)
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持温度、压强不变,t1时充入SO3(g)
C.维持温度不变,t1时扩大反应体系体积
D.维持压强不变,t1时升高反应体系温度
13.下列化学实验事实及其解释都正确的是
A.升高温度化学反应速率加快,是因为单位体积内活化分子百分数增加
B.将SO2通入Ba(NO3)2溶液,有白色沉淀生成,说明BaSO3难溶于硝酸
C.由“同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大,可知C比S非金属性弱
D.滴有酚酞的Na2CO3溶液中滴加BaCl2溶液后红色变浅,说明BaCl2溶液有酸性
12.为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,向滤液中加入适量盐酸,这种试剂是
A.NH3 • H2O B.NaOH C.Na2CO3 D.MgCO3
11.常温下,一定量的醋酸与氢氧化钠溶液发生中和反应。下列说法正确的是
 A.当溶液中c(CH3COO-)
= c(Na+)时,醋酸与氢氧化钠恰好完全反应
A.当溶液中c(CH3COO-)
= c(Na+)时,醋酸与氢氧化钠恰好完全反应

 B.当溶液中c(CH3COO-)
= c(Na+)时.一定是氢氧化钠过量过量
B.当溶液中c(CH3COO-)
= c(Na+)时.一定是氢氧化钠过量过量
 C.当溶液中c(CH3COO-)
= c(Na+)>c(H+) =
c(OH-)时,一定是醋酸过量
C.当溶液中c(CH3COO-)
= c(Na+)>c(H+) =
c(OH-)时,一定是醋酸过量
D.当溶液中c(Na+)>c(CH3COO-) >c(OH-)>c(H+)时,一定是氢氧化钠过量

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com