
1、之所以要大兴求真务实之风,弘扬求真务实精神,是因为( )
A、自然界和人类社会的发展依赖于人的意识
B、哲学是世界观和方法论的统一
C、只要树立正确的世界观和方法论,办事情就能取得成功
D、正确的世界观和方法论是人们科学地认识世界和改造世界的伟大的认识工具。
32.7.68gCu与200mL2.0mol/L稀HNO3溶液充分反应。假设反应后的溶液仍为 200mL,求此时溶液中NO3-的物质的量浓度 。
个旧一中2009-2010学年第一学期期中检测
31.在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:(1)NO2的转化率为多少?(2)反应开始时与平衡时的压强比为多少?(3)用O2来表示的反应速率是多少mol·L-1·min-1。
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:(1)NO2的转化率为多少?(2)反应开始时与平衡时的压强比为多少?(3)用O2来表示的反应速率是多少mol·L-1·min-1。
30.(9分)某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:
(1)写出用熟石灰和氯化铵反应制氨气的化学方程式:
。
(2)本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无色硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:_______ _,这个反应说明氨气具有________ (填编号)
A.碱性 B.还原性 C.氧化性能 D.不稳定性
(3)洗气瓶中盛浓硫酸的主要作用是_____________ ___。
(4)在最后的出气的导管口收集干燥、纯净的氮气,收集方法是: ______。(填编号) A.排气法 B.排水法 C.用气囊收集
(5)装置E的作用是___________ __。装置F的作用是 _________________。
29.(6分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
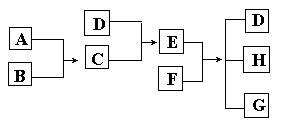
(1) D的化学式(分子式)是_____________,E的化学式(分子式)是_____________。
(2) A和B反应生成C的化学方程式是______________________________。
(3) E和F反应生成D、H和G的化学方程式是:
________ _____________________ _____。 三.实验题(9分)
28.(10分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)该反应达到平衡时SO2的转化率为(用百分数表示) ;
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀 克。
27. (8分)在一密闭容器中进行可逆反应mA(g)+nB(g)
(8分)在一密闭容器中进行可逆反应mA(g)+nB(g)  pC(g)+qD(g),符合下图,试用“>”或“<”填(1)-(3)题.
pC(g)+qD(g),符合下图,试用“>”或“<”填(1)-(3)题.
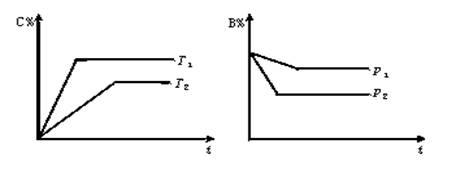
(1)温度T1 T2;(2)压强p1 p2;
(3)m+n p+q;(4)正反应为 反应(填“放热”或“吸热”)。
26.(4分)配平下列化学(或离子)方程式: (1) Cu2S + HNO3 -- Cu(NO3)2+ NO↑ + H2SO4+ H2O (2) SO32- + MnO4- + H+ -- Mn2+ + SO42- + H2O
25.对已达化学平衡的下列反应:2X(g)+Y(g)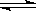 2Z(g),减小压强时,对反应产生的影响是
2Z(g),减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
第Ⅱ卷 非选择题
24.在一个固定体积的密闭容器中,一定温度下,加入2molBr2、1molH2,发生反应:Br2(g)+H2(g) 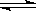 2HBr(g),达到平衡时,HBr的质量分数为w%,在相同条件下,按下列情况充入物质,达到平衡时,HBr的质量分数仍为w%的是
2HBr(g),达到平衡时,HBr的质量分数为w%,在相同条件下,按下列情况充入物质,达到平衡时,HBr的质量分数仍为w%的是
A.2molHBr B.3molHBr
C.2molBr2 + 1molHBr D.3molBr2 +1molH 2+2molHBr
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com