
9.若 ,对任意实数
,对任意实数 都有
都有 ,且
,且 , 则实数
, 则实数 的值等于
的值等于
A  B
B  C -3或1 D
-1或3
C -3或1 D
-1或3
8.在△ 中,
中, 、
、 、
、 分别是角
分别是角 所对的边,∠
所对的边,∠ =60º,
=60º, , △
, △ 的面积
的面积 =
= ,则
,则 的值等于
的值等于
A  B
B
 C
C  D
D
7. 已知O,N,P在 所在平面内,且
所在平面内,且 ,
,
且 ,则点O,N,P依次是
,则点O,N,P依次是 的
的
A.重心 外心 垂心 B.重心 外心 内心 C.外心 重心 垂心 D.外心 重心 内心
4. 数列1,,,…, 的前n项和为
A B C D
5 已知 ,
, ,则
,则 的大小关系为
的大小关系为
A  B
B  C
C  D
D
6 将函数y=sin2x的图像向左平移 个单位,得到y=f(x)的图像,则函数f(x)的单调递增区间是
个单位,得到y=f(x)的图像,则函数f(x)的单调递增区间是
A  B
B
C D
D 
3.已知 则
则 的值是
的值是
A. B.
B. C.
C.  D.
D.
1 不等式 的解集是
的解集是
A. B.
B.  C.
C. D.
D. 
2.设 是等差数列
是等差数列 的前n项和,若
的前n项和,若 则
则
A.1
B. C.2 D.
C.2 D.
26、(8分)有NaOH和NaHCO3的混合物。
(1)取10.4g该混合物与足量的盐酸反应。若收集到气体V L(标准状况),则原混合物中NaOH的质量分数ω(NaOH)=
(只写表达式,可不化简);
(2)取10.4g该混合物与100mL1.00mol/L的盐酸充分反应后,若收集到气体1.12L(标准状况),则原混合物中:n (NaOH)= ,m (NaHCO3)= 。
(3)设该混合物中n(NaOH)/n(NaHCO3)=x,取该化合物10.4g于一容器内充分加热后,再排出气体,固体质量减少了m.试通过计算确定m的取值范围:
x<1时,m 。
25、(6分) 某混合物的水溶液中,可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、Cl-、CO32-和SO42-。现每次取100.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______________;
(2)K+是否存在?_____,(填“是”或“否”)若存在,浓度范围是____________________ (若不存在,则不必回答第(2)问);
(3)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
____________________________________________________________________
____________________________________________________________________;
24、(14分) A、B、C、D、E、F是元素周期表中连续三个短周期的元素,且原子序数依次增大。A与D同主族,B、C同周期且相邻,C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与F的最外层电子数相等,E的简单离子为同周期中离子半径最小的。
回答下列问题:(1)A与B形成的一种液态化合物M与C的一种单质的摩尔质量相等,则M的化学式为 ;
(2)A和C形成的一种具有氧化性的液态化合物N与M恰好完全反应,产生两种无毒又不污染环境的物质X和Y。写出此反应的化学方程式
;
(3)A与B形成的另一种气态化合物Z,写出实验室制取Z的化学方程式
;
(4)C与D按原子个数比1:1所形成的化合物的电子式 ;
(5)六种元素中其中三种元素组成的某种盐,水溶液显碱性,是家用消毒剂的主要成分,
请用离子方程式解释该盐溶液呈碱性的原因 ;
(6)E的单质与D的最高价氧化物的水化物反应的化学方程式
;
(7)A单质与C的单质组成新型燃料电池,写出以KOH为电解质溶液的
负极反应式 。
23、(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
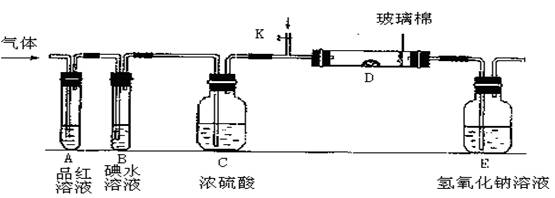 ①分别通入SO2和Cl2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量Cl2时观察到的现象为
;
①分别通入SO2和Cl2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量Cl2时观察到的现象为
;
若装置D中装的是五氧化二钒,当通入足量SO2时,打开K通入适量O2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量Cl2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为
;
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量的下列溶液就有沉淀生成 (填字母);
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
E.双氧水 F.二氧化氮 G.硝酸银 H.硫化氢
(3)若由元素S和O组成负二价酸根Z,Z中S和O的质量比为
m(S)︰m(O)= 4︰3,当Cl2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,该反应的离子方程式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com