
3.如图所示,光滑的平行长直金属导轨置于水平面内,间距为 ,导轨左端接有阻值为R的电阻。质量为
,导轨左端接有阻值为R的电阻。质量为 的导体棒垂直跨接在导轨上,导轨和导体棒的电阻均不计,且接触良好。通过沿导轨安装的通电线圈,在一矩形区域内产生匀强磁场,磁场方向竖直向下,磁感应强度的大小为B。开始时,导体棒静止于磁场区域的右端,当磁场以速度v1匀速向右移动时,导体棒随之开始运动,并很快达到恒定速度。已知导体棒在运动中所受到的阻力为其对地速度的k倍,设导体棒运动中始终处于磁场区域内。求:
的导体棒垂直跨接在导轨上,导轨和导体棒的电阻均不计,且接触良好。通过沿导轨安装的通电线圈,在一矩形区域内产生匀强磁场,磁场方向竖直向下,磁感应强度的大小为B。开始时,导体棒静止于磁场区域的右端,当磁场以速度v1匀速向右移动时,导体棒随之开始运动,并很快达到恒定速度。已知导体棒在运动中所受到的阻力为其对地速度的k倍,设导体棒运动中始终处于磁场区域内。求:
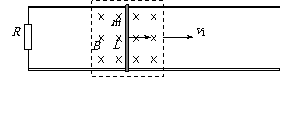 (1)导体棒开始运动时的加速度a;
(1)导体棒开始运动时的加速度a;
(2)导体棒所达到的恒定速度v2;
(3)在(2)情况下每秒钟消耗的磁场能。
2.如图所示的竖直平面内有范围足够大、水平向左的匀强电场,在虚线的左侧有垂直纸面向里的匀强磁场,磁感应强度大小为 。一绝缘“
。一绝缘“ ”形管杆由两段直杆和一半径为
”形管杆由两段直杆和一半径为 的半圆环组成,固定在纸面所在的竖直平面内。
的半圆环组成,固定在纸面所在的竖直平面内。 、
、 水平且足够长,半圆环
水平且足够长,半圆环 在磁场边界左侧,
在磁场边界左侧, 、
、 点在磁场界线上,
点在磁场界线上, 段是光滑的,现有一质量为
段是光滑的,现有一质量为 带电量为
带电量为 的小环套在
的小环套在 杆上,它所受到电场力为重力的1/2倍。现在
杆上,它所受到电场力为重力的1/2倍。现在 右侧
右侧 点由静止释放小环,小环恰好能达到
点由静止释放小环,小环恰好能达到 点。
点。
 (1)求
(1)求 间的距离
间的距离 ;
;
(2)求上述过程中小环第一次通过与 等高的
等高的 点时弯杆对小环作用力的大小;
点时弯杆对小环作用力的大小;
(3)若小环与 间的动摩擦因数为
间的动摩擦因数为 (设最大静摩擦力与滑动摩擦力大小相等且电场力 小于最大静摩擦力),现将小环移至
(设最大静摩擦力与滑动摩擦力大小相等且电场力 小于最大静摩擦力),现将小环移至 点右侧
点右侧 处由静止释放,求小环在整个运动过程中因摩擦产生的热量
处由静止释放,求小环在整个运动过程中因摩擦产生的热量 。
。
1.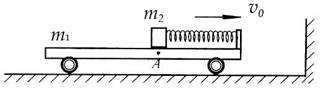 如图所示,在光滑水平地面上,有一质量
如图所示,在光滑水平地面上,有一质量 的平板小车,小车的右端有一固定的竖直挡板,挡板上固定一轻质细弹簧。位于小车上A点处质量
的平板小车,小车的右端有一固定的竖直挡板,挡板上固定一轻质细弹簧。位于小车上A点处质量 的木块(可视为质点)与弹簧的左端相接触但不连接,此时弹簧与木块间无相互作用力。木块与A点左侧的车面之间的动摩擦因数
的木块(可视为质点)与弹簧的左端相接触但不连接,此时弹簧与木块间无相互作用力。木块与A点左侧的车面之间的动摩擦因数 ,木块与A点右侧的车面之间的摩擦可忽略不计。现小车与木块一起以
,木块与A点右侧的车面之间的摩擦可忽略不计。现小车与木块一起以 的初速度向右运动,小车将与其右侧的竖直墙壁发生碰撞,已知碰撞时间极短,碰撞后小车以
的初速度向右运动,小车将与其右侧的竖直墙壁发生碰撞,已知碰撞时间极短,碰撞后小车以 的速度反向弹回,已知重力加速度g取
的速度反向弹回,已知重力加速度g取 ,弹簧始终处于弹性限度内。求:(1)小车撞墙后弹簧的最大弹性势能;(2)要使木块最终不从小车上滑落,则车面A点左侧粗糙部分的长度应满足什么条件?
,弹簧始终处于弹性限度内。求:(1)小车撞墙后弹簧的最大弹性势能;(2)要使木块最终不从小车上滑落,则车面A点左侧粗糙部分的长度应满足什么条件?
3.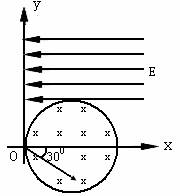 如图所示,真空中有以(
如图所示,真空中有以( ,0)为圆心,
,0)为圆心, 为半径的圆柱形匀强磁场区域,磁感应强度大小为B,方向垂直于纸面向里,在
为半径的圆柱形匀强磁场区域,磁感应强度大小为B,方向垂直于纸面向里,在 的上方足够大的范围内,有方向水平向左的匀强电场,电场强度的大小为
的上方足够大的范围内,有方向水平向左的匀强电场,电场强度的大小为 ,从
,从 点向不同方向发射速率相同的质子,质子的运动轨迹均在纸面内,设质子在磁场中的偏转半径也为
点向不同方向发射速率相同的质子,质子的运动轨迹均在纸面内,设质子在磁场中的偏转半径也为 ,已知质子的电量为
,已知质子的电量为 ,质量为
,质量为 ,不计重力及阻力的作用,求:
,不计重力及阻力的作用,求:
(1)质子射入磁场时的速度大小;
(2)速度方向沿 轴正方向射入磁场的质子,到达
轴正方向射入磁场的质子,到达 轴所需的时间;
轴所需的时间;
(3)速度方向与 轴正方向成30º角(如图中所示)射入磁场的质子,到达
轴正方向成30º角(如图中所示)射入磁场的质子,到达 轴的位置坐标。
轴的位置坐标。
2.如图所示,一质量m2=0.25kg的平板小车,车顶右端放一质量m3=0.2kg的小物体,小物体可视为质点,与车顶之间的动摩擦因数μ=0.3,小车静止在光滑的水平轨道上。现有一质量m1=0.05kg的子弹以水平速度v0=15m/s射中小车左端,并留在车中(子弹与车相互作用时间很短)。若使小物体不从车顶上滑落,求:
 (1) 物体与车的共同速度为多少? (2) 小车的最小长度应为多少?
(1) 物体与车的共同速度为多少? (2) 小车的最小长度应为多少?
(3) 小木块在小车上滑行的时间。
(计算中g 取10m/s2)
1.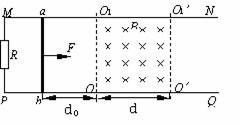 如图,光滑平行的水平金属导轨MN、PQ相距l,在M点和P点间接一个阻值为R的电阻,在两导轨间OO1O1′O′′矩形区域内有垂直导轨平面竖直向下、宽为d的匀强磁场,磁感应强度为大小为B。一质量为m、电阻为r的导体棒ab,垂直放在导轨上,与磁场左边界相距d0。现用一大小为F、水平向右的恒力拉ab棒,使它由静止开始运动,棒ab在离开磁场前已经做匀速直线运动(棒ab与导轨始终保持良好的接触,导轨电阻不计)。求:
如图,光滑平行的水平金属导轨MN、PQ相距l,在M点和P点间接一个阻值为R的电阻,在两导轨间OO1O1′O′′矩形区域内有垂直导轨平面竖直向下、宽为d的匀强磁场,磁感应强度为大小为B。一质量为m、电阻为r的导体棒ab,垂直放在导轨上,与磁场左边界相距d0。现用一大小为F、水平向右的恒力拉ab棒,使它由静止开始运动,棒ab在离开磁场前已经做匀速直线运动(棒ab与导轨始终保持良好的接触,导轨电阻不计)。求:
(1)棒ab在离开磁场右边界时的速度v;
(2)棒ab通过磁场区的过程中整个回路所消耗的电能E。
21.(9分)某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识,并对感兴趣的问题进行探讨。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
(1)计算此钢样粉末中铁和碳的物质的量之比。
(2)再取三份不同质量的钢样粉末分别加到100mL相同浓度的稀H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
(3)若在实验Ⅱ中继续加入3.812g钢样粉末,计算反应结束后剩余的固体质量为多少?
江苏省苏州中学2010届高三阶段测试一
20.(16分)硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢:(皓矾为ZnSO4•7H2O)

(1)上述流程中共有7个化学反应,其中有____________个属于氧化还原反应。
(2)写出过氧化氢和物质C的电子式:____________________,_______________。
(3)写出F、G的化学式: F_____________、G_________________。
(4)写出下列化学反应方程式:
反应③__________________________________________________________。
反应⑦____________________________________________________。
(5)取锌钡白固体16.5g溶于100mL 1mol/L的H2SO4 溶液中,放出H2S 气体1008mL(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为________mol/L
②加热驱尽溶液中H2S 后,为使锌离子完全沉淀,应加入 1 mol/L的NaOH溶液_____mL
19.(15分)氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝样品中可能含有碳或氧化铝中的一种杂质,现用如图Ⅰ所示的装置来进行检验。使氮化铝样品和氢氧化钠溶液反应:
AlN + NaOH + H2O = NaAlO2 + NH 3 ↑ 根据反应中所产生氨气的体积来测定样品的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
3 ↑ 根据反应中所产生氨气的体积来测定样品的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
(1)  实验有关操作:
实验有关操作:
A. 往圆底烧瓶中放入AlN样品w g,并向广口瓶中加入
水和X液体;
B. 往圆底烧瓶中加入一定体积的过量的浓NaOH溶液;
C. 检验装置的气密性;
D.读取收集到的水的体积;
正确的操作顺序为__________________________________________。
(2)本实验中检验装置气密性的方法是_____________________________________。
(3)广口瓶中的试剂X可选用__________________(填选项的标号)
A.丁烷 B. 酒精 C. 植物油 D. 四氯化碳
其理由______________________________________。
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是___________。
(5)实验结束后,量筒中收集到水的体积为a L,若当时的实验条件为标准状况,则样品中AlN的质量分数为______________________(AlN的相对分子质量为41),这一测定结果比实际值偏低,你认为可能的原因是__________________ ________.
________.
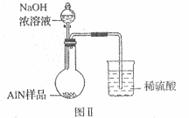 (6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定
烧杯中硫酸的增重来确定样品AlN的质量分数。你认为
这样的改进是否可行?_____________________(填
“可行”或“不可行”),理由是____________________
_______________________________。
18.(18分)某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品 溶解,然后准确配制成250.00mL溶液;
溶解,然后准确配制成250.00mL溶液;
③ 量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)步骤②中加入盐酸的作用________________________________________________。

(3)写出步骤④中发生反应的离子方程式
 。
。
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
___Fe2+ + ___ClO3- + = __Fe3+ + ___Cl- + ___H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的NaClO3与Cl2的氧化效率之比为
(5)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是
 。
。
(6)本实验需要称量的最少次数是 次,若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2 + 6NaOH  5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
则Fe3+、KClO3、Cl2三种物质其氧化性由强到弱的顺序是_________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com