
10.答案解析:(中难)考查对ⅠA族和ⅡA族元素的相似性和递变性的理解,答案:B。用酒精灯加热(500℃)Na2CO3是不会分解的,而MgCO3加热到350℃时就分解了,A错。由于Ba(OH) 2是二元强碱,KOH是一元强碱,等浓度时Ba(OH) 2碱性强于KOH,B正确。在同一周期中,ⅠA族单质的熔点比ⅡA族的低,如Na的熔点97℃,Mg的熔点是648.8℃,同样氧化物的熔点也是MgO高。因为前者ⅡA族金属的键能大于ⅠA族的金属,后者是MgO离子键的键能高于Na2O。Mg (OH) 2是二元碱,但Mg (OH) 2是难溶物质,碱性弱于NaOH。
10.关于ⅠA族和ⅡA族元素的下列说法中正确的是( )
A.加热时,Na2CO3比MgCO3易分解
B.浓度都是0.01 mol·L-1时,KOH溶液的pH比Ba(OH) 2的小
C.Na的熔点比Mg高,Na2O的熔点比MgO的高
D.NaOH是一元碱,Mg (OH) 2是二元碱,后者碱性强
9. 答案解析:(难)此题考查原电池原理。答案:D。得电子发生还原反应是正极,失去电子发生氧化反应是负极。O2+2H2O+4e-=4OH-应为正极反应式。燃料氧化生成的二氧化碳不可能从强碱溶液中逸出,它将进一步反应转化成碳酸根。所以负极反应式为:CH4+10OH--8e-=CO32-+7H2O。由于部分碱液和二氧化碳反应,所以溶液的pH值将减小。放电时溶液中的阴离子OH-向负极移动。
技能空间:燃料电池属于原电池,解决原电池问题要抓住三个要点:①电极构成:失电子的电极作负极,另一导体作正极。②电流方向:电子由负极流向正极,电流方向是由正极流到负极(外电路)。③电极反应:负极失电子发生氧化反应,溶液中氧化性较强的微粒在正极上得电子而发生还原反应。
9.燃料电池是燃料(如CO,H2,CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是( )
A.负极反应式:O2+2H2O+4e-=4OH-
B.负极反应式:CH4+8OH--8e-=CO2↑+6H2O
C.随着放电的进行,溶液的pH值不变
D.放电时溶液中的阴离子向负极移动
8. 答案解析:(易)本题考查原子结构问题,答案:D。中子数=质量数-质子数 。A 中16O与17O是同位素原子,具有相同的电子数,正确。B中18O含有8个质子,中子数=18-8=10,19F含有9个质子,中子数=19-9=10,正确;C中15N与14N是同位素原子,具有相同的质子数,正确;D中12C与13C的质量数分别是12和13,不正确。
8.下列关于原子的几种描述中,错误的是( )
A.16O与17O具有相同的电子数
B.18O与19F具有相同的中子数
C.15N与14N具有相同的质子数
D.12C与13C具有相同的质量数
7. 答案解析:(中难)考查化学平衡的涵义及其与反应速率之间的内在联系,答案:C。本题与前些年高考中所考的“达到平衡状态的标志”属于同一题型。达到化学平衡时,正反应和逆反应的速率相等,但不为零,化学平衡是动态平衡,反应并没有停止,A错。B中只有正反应速率,无法判断是否平衡,要有正逆反应速率,且速率比符合化学计量数之比,才能说明反应已达到平衡状态,C符合要求。
错点警示:从化学平衡的定义出发来判断是否达到化学平衡的两个要点是:①v正 = v逆 ②能变的量保持不变。达到化学平衡时,反应混合物中各组成成分的百分含量、物质的量浓度等保持不变,并不是指各组成成分的百分含量、物质的量浓度等一定相等或符合某一比例。
7.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
A.达到化学平衡时,正反应和逆反应的速率都为零
B.当符合:3u正(N2)=u正(H2)时,反应达到平衡状态
C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2
D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
6. 答案解析:(易)考查电子式、原子结构示意图、分子式、结构式和结构简式的表示方法,答案:B。白磷的分子式为P4;Na+结构示意图正确;乙醇的结构简式为CH3-CH2-OH或CH3CH2OH或C2H5OH。HClO的结构式为HO-Cl,所以其电子式为: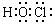 。
。
6.下列各项中表达正确的是( )
A.白磷的分子式:P
B.Na+结构示意图是: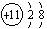
C.乙醇的结构简式C2H6O D.HClO的电子式: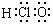
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com