
3.函数 的零点有( )
的零点有( )
A.0个 B.1个 C.2个 D. 3个
2.幂函数 的图像过点(2,4),那么函数
的图像过点(2,4),那么函数 的单调递增区间是 ( )
的单调递增区间是 ( )
A. B.
B. C.
C. D.
D.
1.已知全集U为实数集, 则
则 等于( )
等于( )
A. B.
B.  C.
C.
 D.
D. 
20.(15分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,制取氯气的装置如图。
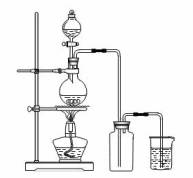
(1)写出制取氯气反应的离子方程式___________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________。
(2)将生成的氯气通入水中,氯气和水反应生成HCl和HClO,HClO不稳定,见光易分解生成HCl和O2,请设计实验证明有O2生成______________________________
_____________________________________________________________________。
(3)已知:H2CO3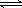 H++HCO3- Ka1 =4.45×10-7
H++HCO3- Ka1 =4.45×10-7
HCO3-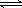 H++CO32- Ka2=5.61×10-11
H++CO32- Ka2=5.61×10-11
HClO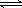 H++ClO- Ka=2.95×10-8
H++ClO- Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中________________________________;②氯气和碳酸钠按照物质的量之比为1:1恰好完全反应____________________________。
(4)若将生成的氯气通入石灰乳充分反应,加热蒸干,可制得漂白粉。工业上常用漂白粉与稀硫酸反应放出的氯气的质量对漂白粉质量的百分比(x%)来表示漂白粉质量的优劣。现为测定一瓶漂白粉的x%,进行如下实验:称取漂白粉样品2.00g,研磨加水后,转入250mL容量瓶中,用水稀释至刻度。摇匀后,取出25.00mL,加入过量的KI溶液和过量的稀硫酸,静置。待完全反应后,用0.10mol·L-1的Na2S2O3溶液测定反应中生成的碘,所发生的反应为:2Na2S2O3+ I2= Na2S4O6+2NaI。反应用去Na2S2O3溶液20.00mL。
①称取漂白粉样品选用的仪器是__________。滴定时应选用的指示剂是________,判断滴定达到终点的方法是______________________________________________
__________________________________________________。
②试由上述数据计算该漂白粉的x%,简要写出计算过程。
19.(12分)市场上一种新型洗涤剂的主要化学成分是两种常见物质固体A和液体B形成的白色结晶化合物,某化学小组对该洗涤剂进行探究,实验过程如下:
(1)提出问题:该洗涤剂中A和B各是什么?它们的配比如何?
(2)定性实验探究:
|
序号 |
主要操作步骤 |
主要实验现象 |
结论 |
|
① |
取少量洗涤剂,加水溶解,用洁净的铂丝蘸取溶液,在酒精灯火焰上灼烧 |
火焰呈黄色 |
洗涤剂中含Na+ |
|
② |
取溶液1-2mL于试管中,滴入酚酞溶液,振荡,然后加入MnO2粉末少许,并将带火星的木条伸入试管内 |
溶液先变红,后逐渐褪色;气泡冒出剧烈,木条复燃 |
A为______ B为______ |
|
③ |
取②上层清液少许,加入足量稀硫酸,将燃着的木条伸入试管内;另取②上层清液少许,滴入稀MgCl2溶液 |
有无色无味气体放出,木条火焰熄灭,有白色沉淀生成 |
(3)定量实验探究:为测定洗涤剂中A和B的配比,请从下图中选择适当的仪器,组装一套测定某物理量的最简便的装置,该装置的连接顺序从左至右是(填各接口的字母代号)___________________,测定的物理量是_______________________,欲达实验目的还必须知道的物理量是______________________。
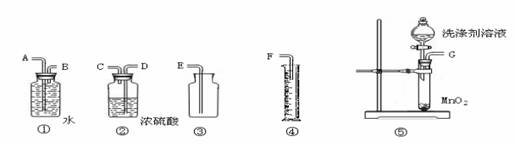
(4)根据该结晶化合物的性质,请从消费者安全的角度考虑,你认为在使用该洗涤剂时应注意的事项是__________________________________________________(写出任意一点即可)。
18.(15分)工业上以天然气为原料合成氨的主要步骤如图。
试回答下列问题:
(1)写出CH4和H2O(g)反应的化学方程式_________________________________;在该反应中,还原剂为______________。

(2)一定温度下,在体积不变的容器中,
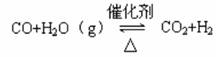 充入CO和H2O(g)各0.1mol,发
充入CO和H2O(g)各0.1mol,发
生如下反应一段时间后,通过实验判
断该反应达到平衡状态的宏观标志是
________________________________。
查阅资料得知,该温度下,反应的平衡常数为1。则反应达到平衡后,平衡混合物中CO的物质的量为_________。请设计实验,证明平衡混合物中存在CO,简述实验方案__________________________________________________________。
(3)一定条件下,将生成的NH3和CO2按体积比2:1通入水中,反应的离子方程式为__________________________________________。为确定得到的溶液中NH4+、CO32-、H+和OH-浓度大小顺序,可以通过理论推算,也可通过实验确定。通过理论推算,则必须查阅的数据为_________________________________;通过实验确定,则需要进行的简单实验为_______________________________。
(4)从绿色化学的角度考虑,上述流程中的CO2和NH3可直接合成尿素。尿素是第一种人工制备的有机物,可在空气中燃烧。下列有机物在空气中燃烧时,生成的CO2和H2O物质的量之比为1:2的是__________(填字母)。
A.甲醇 B.乙酸 C.葡萄糖 D.尿素
17.(10分)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。
(1)甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中铁元素呈______价,其理由是________________________________________________________________。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案_________________
_______________________________________________________________。
(2)乙同学查阅资料得知:草酸的酸性比醋酸强,草酸钙难溶于水,是一种白色沉淀。乙同学依据上述信息推测,在菠菜汁中加入CaCl2溶液,应析出草酸钙白色沉淀,加入醋酸白色沉淀不溶解,反应的离子方程式为________________________。但在实际操作中,发现白色沉淀部分溶解,且放出无色无味气体。乙同学推测放出的气体是_________,其理由是___________________________________________。
(3)丙同学依据甲、乙同学提供的资料和实验事实,认为菠菜与豆腐不宜同食,其主要理由是____________________________________________________________。
16.下列说法正确的是 ( )
A.根据Ksp(AgCl)=1.77×10-10mol2·L-2,Ksp(Ag2CrO4)=1.12×10-12mol3·L-3,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体最终得不到ZnS沉淀是因为溶液中c(Zn2+)·c(S2-)<Ksp(ZnS)
C.向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的小
D.AgCl在10mL 0.01mol·L-1的KCl溶液中比在20mL0.05mol·L-1的AgNO3溶液中溶解的质量少
第Ⅱ卷(共52分)
15.某新型铝-空气燃料电池,以铝合金为负极,在正极通入空气,若以NaCl溶液或NaOH溶液为电解质溶液,放电时正极反应都为O2+2H2O+4e-=4OH-。下列说法正确的是
( )
A.若以NaCl溶液为电解质溶液,电池负极反应为:Al+4OH--3e-=[Al(OH)4]-
B.若以NaOH溶液为电解质溶液,电池负极反应为:Al+4OH--3e-=[Al(OH)4]-
C.若以NaOH溶液为电解质溶液,电池在工作过程中电解质溶液的pH保持不变
D.以NaCl溶液或NaOH溶液为电解质溶液,两个电池总反应相同。
14.浓度均为0.1mol·L-1的三种溶液:①醋酸溶液、②氢氧化钠溶液、③醋酸钠溶液,下列说法不正确的是 ( )
A.①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH)
B.①和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.②和③等体积混合后溶液水电离出的c(H+)减小
D.水电离出的c(OH-):②>③>①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com