
19、Ⅰ (10分) (1)Si N S As P (4分) (2)H2SO4>H3PO4>H3AsO4 (3分) (3)NH3>PH3>SiH4(3分)
Ⅱ
(8分)⑴K= 向右 ⑵①C ②>
向右 ⑵①C ②>
21、(13分)某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验。
(1)如何检验该装置的气密性
。
(2)合金样品固体M与氢氧化钠溶液反应的离子方程
式 。
(3)倾斜左边装置使氢氧化钠溶液(足量)与ag合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL.,则固体M中铝的质量(mA1)范围为 。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积 (填“>”“<”“=”)VmL。
(5)若a=38mg,V=44.8mL(标准状况),请通过计算说明该合金是否符合国家标准(不写计算过程) (填“符合”或“不符合”)。
化学阶段性综合模拟题答案
1-5ADDCD6-10CDCBD11-15CCDCD16-17CC
18 Ⅰ(6分) ⑴③⑤(2分) ⑵①大于②小于③大于④小于(每空1分共4分)
Ⅱ(8分 )(1)
(2)1:4 (3)酸性 氧化性 (4)0.8mol(无单位不得分)
20、(14分) 以下为中学常见物质,转化关系如下。C与B溶液反应产生气体F,D可在F中燃烧,图中部分产物略去。
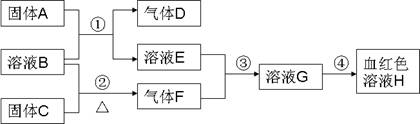
(1)写出固体C化学式
(2)实验室用①制取D、B溶液应为 溶液(“浓”或“稀”);若用②制取F,B溶液应为 溶液(“浓”或“稀”)。写出②反应方程式
(3)如何检验E中的阳离子
(4)实验室配制G溶液,操作为
(5)除③可实现E→G外,请用其他物质实现E→G,化学方程式
(6)4gD在空气中完全燃烧生成液体物质时,放出热量为QkJ,写出该反应的热化学方程式

19、Ⅰ(10分) A、B、C、D四种元素在周期表中分别处于元素X的四周(如下图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
(1)各元素的符号:
A:_____,B:____,C:____,D:_____,X:_____。
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:___________。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:__________________。
Ⅱ(8分)Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+ 2Fe2++I2(水溶液),
2Fe2++I2(水溶液),
⑴该反应的平衡常数K的表达式为:K= ___________________________
[物质的浓度用“c(物质)”表示]。当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(填“向右”、“向左”、“不”)。
⑵上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
|
|
c(I-)(mol/L) |
c(Fe3+)(mol/L) |
v[mol/(L·s)] |
|
⑴ |
0.20 |
0.80 |
0.032K |
|
⑵ |
0.60 |
0.40 |
0.144K |
|
⑶ |
0.80 |
0.20 |
0.128K |
通过所给的数据计算得知:
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为_________。
A. m=1、n=1 B. m=1、n=2 C. m=2、n=1 D. m=2、n=2
②I-浓度对反应速率的影响_______Fe3+浓度对反应速率的影响(填“>”、“<”或“=”)。
18、(14分)Ⅰ⑴玻璃棒是中学化学实验中常用的仪器。下列过程中,一般不需要玻璃棒的是 ( 填写编号 )
①用PH试纸测定Na2CO3溶液的PH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化。
⑤实验室用新制备的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
⑵用“大于”“等于”“小于”填空
① 读量筒中液体的体积时,视线偏高,读取的体积数 实际体积数
② 用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称食盐的质
量 10.4g
③配制500ml 0.1mol/lNaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓
度 0.1mol/l
④用中和滴定法测某NaOH溶液的浓度,量取待测液未用该溶液润洗滴定管,测得的溶液的浓度 实际浓度
Ⅱ、氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:

 、
、 、
、 、
、
 四种物质中的一种物质能使上述还原过程发生。
四种物质中的一种物质能使上述还原过程发生。
(1)写出该氧化还原反应的方程式(不配平): 。
(2)该反应中氧化剂和还原剂物质的量之比为 。
(3)反应中硝酸体现了 、 性质。
(4)反应中若产生0.1mol气体,则转移电子的物质的量是 。
|
|
B |
|
|
A |
X |
C |
|
|
D |
|
17、 已知298K时, N2(g)+3H2(g)=2 NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
A.Q1 = Q2 = 92.4kJ B.Q2 < Q1 = 92.4kJ
C.Q2< Q1< 92.4kJ D..Q2 = Q1 < 92.4kJ
第Ⅱ卷( 非选择题,共60分)
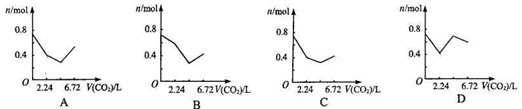
16、 向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解) C
15、 在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是
A.9:4 B.1:1 C.7:6 D.6:7
14、
已知某溶液中存在 ,
, ,
, 和
和 四种离子,其浓度大小有如下关系,其中可能的是
①
四种离子,其浓度大小有如下关系,其中可能的是
①
②
③ 且
且 ④
④
⑤
A.①④ B.③⑤ C.①②③ D.④⑤
13、 0.1mol/L的CH3COONa溶液和0.1mol/L的盐酸等体积混合后,溶液中离子浓度关系符合实际的是
0.1mol/L的CH3COONa溶液和0.1mol/L的盐酸等体积混合后,溶液中离子浓度关系符合实际的是
A.c( )>c(CH3COOH)
)>c(CH3COOH)
B.c( )+c(
)+c( )=c(
)=c( )+c(
)+c( )
)
C.c( )+c(
)+c( )>c(
)>c( )
)
D.c( )+c(CH3COOH)=c(
)+c(CH3COOH)=c( )
)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com