
16.下列说法正确的是 ( )
A.根据Ksp(AgCl)=1.77×10-10mol2·L-2,Ksp(Ag2CrO4)=1.12×10-12mol3·L-3,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体最终得不到ZnS沉淀是因为溶液中c(Zn2+)·c(S2-)<Ksp(ZnS)
C.向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的小
D.AgCl在10mL 0.01mol·L-1的KCl溶液中比在20mL0.05mol·L-1的AgNO3溶液中溶解的质量少
第Ⅱ卷(共52分)
15.某新型铝-空气燃料电池,以铝合金为负极,在正极通入空气,若以NaCl溶液或NaOH溶液为电解质溶液,放电时正极反应都为O2+2H2O+4e-=4OH-。下列说法正确的是
( )
A.若以NaCl溶液为电解质溶液,电池负极反应为:Al+4OH--3e-=[Al(OH)4]-
B.若以NaOH溶液为电解质溶液,电池负极反应为:Al+4OH--3e-=[Al(OH)4]-
C.若以NaOH溶液为电解质溶液,电池在工作过程中电解质溶液的pH保持不变
D.以NaCl溶液或NaOH溶液为电解质溶液,两个电池总反应相同。
14.浓度均为0.1mol·L-1的三种溶液:①醋酸溶液、②氢氧化钠溶液、③醋酸钠溶液,下列说法不正确的是 ( )
A.①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH)
B.①和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.②和③等体积混合后溶液水电离出的c(H+)减小
D.水电离出的c(OH-):②>③>①
13.一定条件下,化学反应2H2+O2=2H2O的能量变化如图所示,则反应的热化学方程式可表示为 ( )

A.H2(g)+ O2(g)=H2O(g);△H=(a+b)kJ·mol-1
O2(g)=H2O(g);△H=(a+b)kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g);△H=2(b-a)kJ·mol-1
C.H2(g)+ O2(g)=H2O(l);△H=(b+c-a)kJ·mol-1
O2(g)=H2O(l);△H=(b+c-a)kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l);△H=2(a-b-c)kJ·mol-1
12.下列说法不正确的是 ( )
A.当镀锡铁制品的镀层破损后,镀锡铁比镀锌铁更耐腐蚀,镀层能对铁制品起电化学保护作用
B.离子化合物中可以不含金属元素
C.12C和14C互为同位素,而C60与C70互为同素异形体
D.若硝酸与锌反应还原的产物为N2O,被还原硝酸与未被还原硝酸的物质的量之比为1:4
11.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,建立平衡需要的时间为20s则下列说法不正确的是 ( )
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.2 |
0.1 |
0.1 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.2 |
A.反应可表示为3X+Y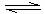 2Z
2Z
B.建立平衡过程中,用Z表示的反应速率为v(Z)=0.005mol·L-1·s-1
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.若初始浓度:X为0.2mol·L-1,Y为0.2mol·L-1,Z为0.8mol·L-1,则平衡向右移动
10.下列现象或事实可用同一原理解释的是 ( )
A.浓硫酸和浓盐酸久置在空气中浓度降低
B.漂白粉和亚硫酸钠固体长期暴露在空气中变质
C.氯水和二氧化硫使品红溶液褪色
D.硝酸银和溴化银用棕色瓶保存
9.下列各组溶液中,只用括号内的试剂及物质间相互反应无法鉴别的一组是 ( )
A.Ba(OH)2 KSCN NaCl Mg(NO3)2(FeCl3溶液)
B.NaNO3 NaHCO3 Na2SO3 Na2SiO3(H2SO4溶液)
C.NaBr HCl NaI CaCl2(AgNO3溶液)
D.NH4Cl NaCl CuSO4 AlCl3(KOH溶液)
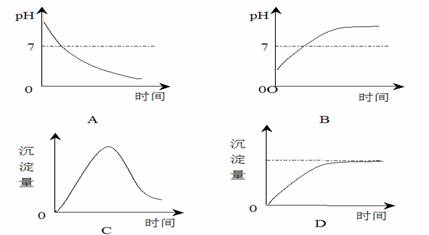
8.用石墨做电极电解AlCl3溶液时,下图的电解过程变化曲线合理的是 ( )
7.下列各组物质之间反应,调节反应物用量,离子方程式不变的是 ( )
A.稀硝酸和Fe B.FeBr2溶液和Cl2
C.AlCl3溶液和NH3·H2O D.NaHCO3溶液和石灰水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com