
13.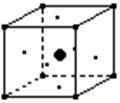 某离子晶体中,存在着A(位于八个顶点)、B(位于正六面体中的六个面上)、C(位于体心)三种元素的原子,其晶体结构中具有代表性的最小重复单位的排列方式如图所示:则该晶体中A、B、C三种原子的个数比是( )
某离子晶体中,存在着A(位于八个顶点)、B(位于正六面体中的六个面上)、C(位于体心)三种元素的原子,其晶体结构中具有代表性的最小重复单位的排列方式如图所示:则该晶体中A、B、C三种原子的个数比是( )
A. 8︰6︰1 B. 1︰1︰1
C. 1︰3︰1 D. 2︰3︰1
(本题考查晶体结构与化学式的关系,答题时注意本题的对象是离子晶体)
12. 下表给出几种氯化物的熔沸点,对此有下列说法:
①CaCl2属于离子晶体 ②SiCl4是分子晶体
③1500℃时,NaCl可形成气态分子
④MgCl2水溶液不能导电
|
|
NaCl |
MgCl2 |
CaCl2 |
SiCl4 |
|
熔点(℃) |
801 |
712 |
782 |
-68 |
|
沸点(℃) |
1465 |
1418 |
1600 |
57 |
与表中数据一致的说法有 ( )
A. 仅① B. 仅② C. ①和② D. ①、②和③
(本题考查氯化物的熔沸点与晶体类型的关系,注意结构与性质的关系)
11.已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论错误的是 ( )
A 氯化铝是电解质
B 固体氯化铝是分子晶体
C 可用电解熔融氯化铝的办法制取金属铝
D 氯化铝为非极性分子
(本题考查AlCl3的结构和性质,注意氯化铝为非极性分子)
10. 美国Lawtcce Lirermre国家实验室(LLNL)的V·Lota·C·S·Yoo和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确的是 ( )
A.CO2的原子晶体和分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
C.CO2的原子晶体和CO2分子晶体具有相同的物理性质
D.在CO2的原子晶体中,每一个碳原子周围结合4个氧原子,每一个氧原子跟两个碳原子相结合
(本题考查原子晶体的结构特征和性质,答题时注意与SiO2的结构和性质进行比较)
9. 最近科学界合成一种“二重结构”的球形物质分子,是把足球型C60分子容纳在足球型Si60分子中,外面的硅原子与里面的碳原子以共价健结合。下列关于这种物质的叙述中正确的是 ( )
A.是混合物 B.是化合物
C.不含极性键 D.含有离子键
(本题考查物质类别的判断,答题时注意结构和类别的关系)
8. M元素的一个原子失去两个电子并转移到Y元素的两个原子中,形成离子化合物Z,下列说法不正确的是( )
A.乙的熔点较高 B.乙可以表示为M2Y
C.乙一定溶于水 D.M形成+2价的阳离子
(本题考查化合物类型和性质,答题时注意化学式的判断)
7.下列每组物质发生状态变化所克服的微粒间的相互作用属于同类型的是 ( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
(本题考查晶体类型和微粒间的相互作用的关系,答题时注意物理变化也可能破坏化学键)
6. 两个原硅酸分子的OH原子团之间可以相互作用而脱去一分子水:2H4SiO4==H6Si2O7+H2O原硅酸结构为(见右图),则在所得的H6Si2O7分子的结构中,含有的硅氧键数目为 ( )
两个原硅酸分子的OH原子团之间可以相互作用而脱去一分子水:2H4SiO4==H6Si2O7+H2O原硅酸结构为(见右图),则在所得的H6Si2O7分子的结构中,含有的硅氧键数目为 ( )
A. 5 B. 6 C. 7 D. 8
(本题考查分子结构特征,答题时先写分子的结构式)
5. 用激光将置于铁室中石墨靶上的碳原子炸松,同时用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜,这种化合物可以比金刚石更坚硬,其原因可能是( )
A.碳、氮原子构成网状结构的晶体
B.碳、氮的单质化学性质均不活泼
C.碳、氮键比金刚石中的碳碳键更短
D.氮原子最外层电子数比碳原子多
(本题考查原子晶体的结构和性质,注意结构与性质的关系)
4. 共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种相互作用的晶体是 ( )
A.SiO2晶体 B.CCl4晶体
C.NaCl晶体 D.NaOH晶体
(本题考查构成物质微粒间的相互作用与晶体类型的关系)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com