
15.Ti14C13
讲析:构成分子晶体的原子只属于一个分子,不与其它分子共用。
第10课时 (B卷)
纠错训练
14. (1)HF,‚HCl,ƒHI,„H2S,…NaOH,†NH3、MgO、NaHCO3
(2)NaCl、NaOH、NaHCO3;‚
(3)CO2、SO2、H2O;‚SiO2
(4)CH4,‚H2O,ƒCH4,„MgO、SiO2
10.D 11.C 12.D 13.C
讲析:1.可以具有教强氢键的F、O、N,CH4中的C原子没有孤对电子,不存在氢键。 3.铵盐由非金属元素组成却存在共价键,H2O2存在非极性键。 5. 碳、氮原子结合成碳氮
化合物是原子晶体。 6. 两个原硅酸分子相互作用而脱去一分子水的方式是:一个分子去OH原子团,另一个分子之去H。 7.解题的关键是判断晶体类型。 8.乙的化学式MY2,离子化合物不一定溶于水。 9.微粒间的作用为共价健,故属于共价化合物。 10. CO2原子晶体转化为分子晶体时发生了结构的变化,故为化学变化;但属于化合物,所以不互为同素异形体。 11.先根据AlCl3的物理性质推知为分子晶体,再判断它的其它性质和分子的极性。 12. MgCl2为离子晶体,水溶液能导电。 13. 该晶体中A、B、C三种原子的个数比是: (8╳1/8):(6╳1/2):1 = 1:3:1
1.D 2.C 3.B 4.BD 5.AC 6.D 7.C 8.BC 9.B
4.⑴ A:NH3 B:HCN C:CO(NH2)2 D:BF3
⑵ 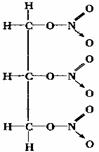
讲析:注意理清原子实和配位共价键的含义及表达。
新活题网站
1.C 2.C 3.BD
讲析:1.分子的电子式的书写,主要是注意共用电子对的数目,同时不要忘记未参与成键的电子。 2.金属晶体的熔沸点有的很高如W,有的很低如碱金属。 3.组成分子的元素化合价是形成8电子结构的价态时符合题意。
16. ⑴中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为 74.7g/mol)。
⑴中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为 74.7g/mol)。
⑵天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如右图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电
中性,但化合物中Ni和O的个数比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
第10课时 (A卷)
典型题点击
15. 已知某元素A能与ⅦA族某一元素B生成A的最高价化合物X,在化合物X中B的含量为92.2%,而在与此相应的A的氧化物Y中,氧的含量为72.7%。A与B生成的化合物X为一无色透明液体,沸点77℃,对氢气的相对密度为77。
回答下列问题(不必给出计算过程):
(1)A元素名称 ,并指出属于第 周期第 族;
(2)X的分子式 ,分子空间构型 ,键角 ;
(3)Y的分子式 ,分子空间构型 ,键角 ;
(4)列举化合物X的两种用途 、 。
14.A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,这四种元素的单质中有2种气体,2种固体。
(1)写出元素符号:A ,B ,C ,D 。
(2)在由A、B、C、D四种元素两两组成的二元化合物中,
非极性分子有 ;其结构中存在非极性键的分子晶体有 ;其结构中存在非极性键的离子晶体有__________;(各填一种物质的化学式)
(3)写出两种均含有A、B、C、D四种元素的化合物两种:
、 。
13. a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数( 单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示)
(3)d溶于水的电离方程式
(4)g微粒所构成的晶体类型属 (5)c微粒是 ,f微粒是 (用化学式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com