
11. 25℃时,几种弱酸的电离常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2S |
|
电离常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1= 1.3×10-7 K2= 7.1×10-15 |
25℃时,下列说法正确的是
A. 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B. a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)> c(CN-),则a一定大于b
C. NaHS和Na2S混合溶液中,一定存在c(Na+)+ c(H+)== c(OH-)+ c(HS-)+2c(S2-)
D. 某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L
10.某课外实验小组设计的下列实验不合理的是

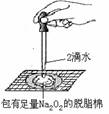
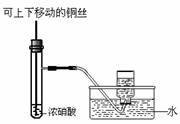
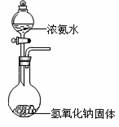
制备并观察氢氧化亚铁 证明过氧化钠与水反应放热 制备并收集少量NO2气体 实验室制备少量氨气
A B C D
9.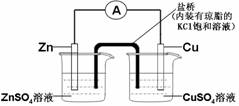 下列表述中,合理的是
下列表述中,合理的是
A. 把SO2通入品红试液,可验证SO2水溶液的酸性
B. 构成如图所示装置时,盐桥中的K+移向ZnSO4溶液
C. 配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,
会使所配溶液的浓度偏低
D. 已知:4NH3 (g) + 3O2 (g) === 2N2 (g) + 6H2O (l) ΔH1
N2 (g) + O2 (g) === 2NO (g) ΔH2
则4NH3 (g) +5O2 (g) === 4NO (g) + 6H2O (l) ΔH3==ΔH1+2ΔH2
8. 下列叙述正确的是
①在CaCl2和NH4Cl中均既含有共价键又含有离子键;②用蒸馏水即可鉴别甲苯、乙醇和四氯化碳三种无色液体;③KAl(SO4)2与Ba(OH)2溶液按照溶质的物质的量之比1:2混合,充分反应后,所得溶液呈中性;
④除去混在SiO2 中的少量CaCO3可加足量盐酸并过滤。
A. ①③ B. ②④ C. ①②④ D. ②③④
7. 中学化学教材中有大量数据,下列是某同学对数据的利用情况,其中正确的是
A.利用焓变的数据或熵变的数据一定都能单独判断反应是否能自发进行
B.利用沸点数据推测将一些液体混合物分离开来的可能性
C.利用反应热数据的大小判断不同反应的反应速率的大小
D.利用溶液的pH与7的大小关系,来判断任何温度下溶液的酸碱性
6.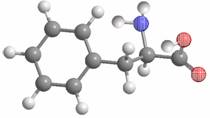 某物质的球棍模型如右图所示,关于该物质的说法不正确的是
某物质的球棍模型如右图所示,关于该物质的说法不正确的是
A. 该物质的结构简式为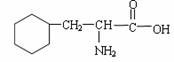
B. 该物质可以发生加成反应
C. 该物质既可以与强酸反应也可以与强碱反应
D. 该物质可以聚合成高分子物质
5.常温下,某无色溶液中由水电离产生的c(H+)=10-12mol/L,则此溶液中一定能大量共存的离子组是
A.Mg2+、NH4+、K+ 、SO42- B.Na+、S2O32-、OH一、Br-
C.Na+、K+、NO3一、SO42一 D.K+ 、Cr2O72-、NO3一、Cl-
4.2008年10月8日,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋科学天才奖”。下列叙述正确的是
A.金属腐蚀就是金属失去电子被还原的过程
B.将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
C.合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强
D.铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e- = Fe3+,继而形成铁锈
3.下列有关叙述正确的是
A.标准状况下,2.24 L C6H14中含有的共用电子对数为1.9×6.02×1023
B.同温同压下,原子数均为6.02×1023的氢气和氦气具有相同的体积
C.0.50 mol的亚硫酸钠中含有的钠离子数为6.02×1023
D.常温下,7.1gCl2与足量NaOH溶液作用,转移电子的数目为0.2×6.02×1023
2. 下列表示正确的是
A. CO2的比例模型:  B. 铝离子的结构示意图:
B. 铝离子的结构示意图: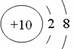
C. 次氯酸的结构式:  D.
甲基的电子式:
D.
甲基的电子式: 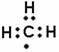
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com