
4.NO和CO都是汽车排放尾气中的有害物质,它们能缓慢的反应,生成氮气和二氧化碳,对此反应下列叙说正确的是( )
A.使用催化剂并不能改变反应速率
B.使用催化剂可以改变反应速率
C.降低压强能加快反应速率
D.升高温度可以加快反应速率
(此题以汽车排放的有害尾气为背景,考查学生对影响化学反应速率因素的认识,及灵活运用理论知识解决实际问题的能力。答题时根据影响化学反应速率的因素及其规律作出判断。)
3.
 设C+CO2 2CO;△H>0,反应速率为v1,N2+3H2 2NH3;△H<0 反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
设C+CO2 2CO;△H>0,反应速率为v1,N2+3H2 2NH3;△H<0 反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
(本题考查学生对化学反应速率受温度影响的掌握情况。答题时注意区分温度对化学反应速率的影响与对化学平衡影响。)
2.下列措施肯定能使化学反应速率增大的是( )
A.增大反应物的量 B.增大压强
C.升高温度 D.使用正催化剂
(此题以影响化学反应速率的因素为依托,考查学生深刻而全面分析问题的能力。答题时根据影响化学反应速率的因素及其适用范围作出判断。)
1.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显
(该题考查学生对化学反应速率概念的理解情况。答题时意义要明确、表示方法要清楚。)
4.(2000年高考科研试测题)下表所列数据是在某高温下金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
|
反应时间t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚Y/nm |
0.05a |
0.20a |
0.45a |
0.80a |
1.25a |
|
NiO层厚Y’/nm |
b |
2b |
3b |
4b |
5b |
注:a和b均为与温度有关的常数
请填空回答:
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是
。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是(填“直线”或“抛物线”,“对数”或“双曲线”等类型):MgO氧化膜膜厚Y属 型,NiO氧化膜膜厚Y’属
型。
(3)Mg与Ni相比较,金属 具有更良好的耐高温氧化腐蚀性,其理由是 。
(该题考查学生获取、分析和处理图表信息的能力及应用数学工具解决化学问题的能力,体现了学生的综合素质。答题时要综合运用化学和数学的某些基本知识,从实验数据出发,建立数学模型(定量规律),进而从物质内部结构作出解释,这是化学研究问题常用的一种方法。)
新活题网站
3.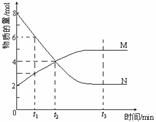 (2001年全国高考题)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
(2001年全国高考题)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
A.反应的化学方程式:2M  N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
(本题以化学反应速率与化学平衡为素材,考查观察图象及其信息加工的能力。答题时要仔细地识图和析图,对速率与平衡的规律加以运用。)
2.(2000年广东高考题)用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
(该题旨在考查学生对影响化学反应速率因素的掌握情况。答题时要综合考虑多方面的因素,注意反应的本质。)
1.反应4A(s)+3B(g) 2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
(本题考查学生对反应速率的理解及表示方法。答题时注意是用何种物质表示反应速率的,指的是平均速率还是瞬时速率。)
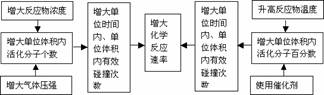
3.外界条件对反应速率的影响,可以概括为“加加、减减”四个字,即增加浓度、增加(升高)温度、增加压强、增加(使用正)催化剂,均可以增大化学反应速率;减小浓度、减小(降低)温度、减小压强、减小(使用负)催化剂,均可以减小化学反应速率。
典型题点击
2.影响化学反应速率的因素
(1)内因(主要因素):参加反应物质的性质。
(2)同一化学反应的速率大小与外界条件(外因)有关。具体规律如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com