
15、 在容积一定的密闭容器中,反应2A B(g)+C(s)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
在容积一定的密闭容器中,反应2A B(g)+C(s)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
A、正反应是吸热反应,且A不是气态 B、正反应是放热反应,且A是气态
C、其他条件不变,加入少量C,该平衡向逆反应方向移动
D、改变压强对该平衡的移动无影响
14、 战性的课题之一。最近有人设计了一种固体燃
战性的课题之一。最近有人设计了一种固体燃
料电池,固体氧化铝--氧化钇为电解质,这
种固体电解质在高温下允许氧离子(O2-)在
其间通过。该电池的工作原理如右图所示,其
中多孔电极a、b均不参与电极反应。下列判
断不正确的是
A、有O2放电的a极为电池的负极
B、b极对应的电极反应式为:
C5H12+16O2--32e-==5CO2+6H2O
C、该电池的总反应方程式为:C5H12+8O2==5CO2+6H2O
D、汽油燃料电池最大的技术障碍是氧化反应不完全,产生炭粒堵塞电极的气体通道,从而使输电效能减弱
13、 与水的电离(2H2O OH-+H3O+)相似,液氨中也存在着极微弱的电离,但这种电离程度比水的电离程度还要弱。下列反应中,属于液氮中的酸碱反应的是
与水的电离(2H2O OH-+H3O+)相似,液氨中也存在着极微弱的电离,但这种电离程度比水的电离程度还要弱。下列反应中,属于液氮中的酸碱反应的是
A、NaNH2+NH2Cl==NaCl+N2H4 B、CaO+2NH4Cl==CaCl2+2NH3+H2O
C、BiN+3NH4Cl==BiCl3+4NH3 D、NH4Cl+NaNH2==NaCl+2NH3
12、对于浓硫酸吸水性的原因,下列叙述合理的是
A、浓硫酸遇水放热,使水蒸发
B、浓硫酸中含有SO3,它与水化合生成硫酸
C、浓硫酸不稳定,容易吸收水变成稳定的稀硫酸
D、浓硫酸吸水能形成一系列稳定的水合物,如H2SO4·H2O
11、已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后二个烧瓶中溶液的关系是
A、溶质的物质的量浓度相同、溶质的质量分数不同
B、溶质的质量分数相同,溶质的物质的量浓度不同
C、溶质的物质的量浓度和溶质的质量分数都不同
D、溶质的物质的量浓度和溶质的质量分数都相同
10、周期表中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似),发Li、Mg;Be、Al;B、Si等两两性质相似。现用熔融LiCl电解的方法可得锂和氧气。若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。据此,下列说法正确的是
A、无色气体为电解生成的锂与水反应放出的H2
B、电解前LiCl在加热时已发生水解
C、电解时产生的无色气体是O2
D、无色气体是阳极放出的Cl2与水作用生成的O2
9、下列说法正确的是(NA表示阿伏加德罗常数)
A、含0.5NA个原子的甲烷的体积为2.24L
B、常温常压下,0.20NA个N2分子的质量是5.6g
C、相同状况下,a L任何气体单质都含有相同的原子数
D、通常状况下,气体的密度之比等于它们的物质的量这比
8、已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A、在Na2A、NaHA两溶液中,离子种类不相同
B、在溶质物质的量相等的Na2A、NaHA两溶液中阴离子叫数相等
C、在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D、在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
7、下列离子方程式正确的是
A、碳酸氢镁溶液和过量的NaOH溶液反应:
Mg2++2OH-=Mg(OH)2↓
B、二氧化硫气体通入过量的Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C、Ba(OH)2溶液中滴入NaHSO4至pH等于7:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
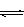 D、KHS的水解:HS-+H2O H2S+OH-
D、KHS的水解:HS-+H2O H2S+OH-
6、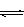 对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图像如右图所示,则图中关于X、Y、Z、W四种物质的聚集状态为
对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图像如右图所示,则图中关于X、Y、Z、W四种物质的聚集状态为
 A、Z、W均为气体,X、Y中有一种是气体
A、Z、W均为气体,X、Y中有一种是气体
B、Z、W中有一种是气体,X、Y皆非气体
C、X、Y、Z、W皆非气体
D、X、Y均为气体,Z、W中有一种为气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com