
1.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)
5.有体积相同的两个密闭容器,分别都充有1mol N2气体和3molH2
气体,在相同温度下发生如下反应:N2(g)+3H2(g)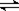 2NH3
2NH3
(g);△H<0,并达到平衡。在这过程中,一容器保持体积不变
(定容容器),另一容器保持压强不变(定压容器),则:
(1)哪个容器中的反应先达到平衡?答:
哪个容器中的N2的转化率高?答:
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5摩氩气,则N2的转化率会起什么变化?正反应速度与原平衡相比,有无变化,简答理由。
(3)若在定容容器中,上述反应达到平衡时,平衡混和物中N2、H2、NH3的物质的量分别为A、B、C摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),应满足的条件是:
①若x=0,y=0,则z= ,
②若x=0.75,则y应为 mol、z应为 mol。
③x、y、z应满足的一般条件是 。
检测提高
4.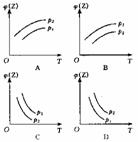 反应:X(g)+3Y(g)
反应:X(g)+3Y(g)
 2Z(g) ;△H<0在不同温度、不同压强
2Z(g) ;△H<0在不同温度、不同压强
(p1>p2)下,达到平衡时,混合气体中Z的体积分数φ随温度变化
的曲线应为( )
3.已知723K时反应:2SO2(g)+O2(g)  2SO3(g);ΔH=-Q。在相同温度下,向一密闭容器中通入2molSO2和1molO2达到平衡时放出热量Q1,向另一容积相同的密闭容器中通入1molSO2和0.5molO2达到平衡时,放出的热量为Q2,则Q1、Q2满足的关系是 ( )
2SO3(g);ΔH=-Q。在相同温度下,向一密闭容器中通入2molSO2和1molO2达到平衡时放出热量Q1,向另一容积相同的密闭容器中通入1molSO2和0.5molO2达到平衡时,放出的热量为Q2,则Q1、Q2满足的关系是 ( )
A.Q2=Q1/2 B.Q2<Q1/2
C.Q2<Q1<Q D.Q1=Q2<Q
2.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的体积分数一定增加;②生成物的产量一定增加;③反应物的转化率一定增大;④反应物浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥使用了合适的催化剂。
A.①② B.②⑤ C.③⑤ D.④⑥
1.对于一可逆反应,改变条件,达到平衡后,生成物浓度增加,平衡移动方向应是( )
A.向左移动 B.向右移动
C.不移动 D.不确定
6.因不注意题给物质的状态,造成了浓度、压强对化学平衡移动影响的误判。
纠错训练
5.改变压强要看有没有改变参加反应的气体浓度,若气体浓度不变,则不能对平衡产生影响。
4.不要把平衡向正反应方向移动与原料转化率提高等同起来。反应物转化率、生成物的含量也可能提高,但也可能降低。
3.不要把v正增大与平衡向正反应方向移动等同起来,只有v正>v逆,才能使平衡向正反应方向移动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com