
4.在一定条件下,气体A可发生反应:2A(g)
 B(g)+3C(g),若已知平衡时所得混合气体对H2的相对密度为4.25,则可推知A的相对分子质量为( )
B(g)+3C(g),若已知平衡时所得混合气体对H2的相对密度为4.25,则可推知A的相对分子质量为( )
A.34 B.8.5 C.17 D.16
(此题考查学生对可逆反应的理解和简单的计算能力。答题时要抓住可逆反应的特征。)
2.下列事实不能用化学平衡移动原理解释的是( )
A.在强碱存在的条件下,酯在水中的溶解性增大
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.500℃左右比室温更有利于合成氨的反应
(该题考查学生对化学平衡移动原理的运用。答题时要明确反应原理,化学反应速率与平衡原理不能混淆。)
1.合成氨厂所需H2可由焦炭与水反应制得,其中有一步反应为:CO(g)+H2O(g)
 CO2(g)+H2(g)
;△H<0,欲提高CO转化率,可采用的方法是( )
CO2(g)+H2(g)
;△H<0,欲提高CO转化率,可采用的方法是( )
①降低温度;②增大压强;③使用催化剂;④增大CO 浓度;⑤增大水蒸气浓度
A.①②③ B.④⑤ C.④ D.⑤
(本题考查学生对化学平衡移动原理的理解和运用。答题时要明确反应原理,注意是两步反应。)
3.(1996年全国高考题)在一个容积固定的反应器中,有一个可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入物质的量如下:A、B和C均为4.0mol,D为6.5mol,F为2.0mol。设E的物质的量为xmol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。请填写以下空白:
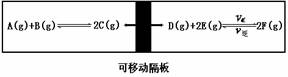
(1)若x=4.5,则右侧反应在起始时向 (填“正反应”或“逆反应”)方向进行,欲使起始反应维持向该反应方向进行,则x的最大值应小于 ;
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A物质的量 (填“相等”、“不相等”或“不能确定”),理由是
。
(该题是涉及化学平衡的移动、阿伏加德罗定律、物质的量等知识的综合性试题。试题既考查了学生相关的化学知识,又考查学生运用数学、语文等基础知识解决化学问题的实际水平。答题时正确理解题意,注意隔板可左右滑动,左边反应的反应前后气体分子数不变。)
新活题网站
2.(2002年全国高考题)1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+a Y(g)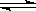 b Z(g)
b Z(g)
反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
A.a=1,b=1 B.a=2,b=1
C.a=2,b=2 D.a=3,b=2
(本题考查学生利用化学方程式进行计算的基本技能,内容还涉及常用的化学计量,如气体体积、密度和物质的量之间的关系以及阿伏加德罗定律等基础知识。解题时,要综合应用这些基础知识和基本技能。)
1.(2001年上海高考题)利用天然气合成氨的工艺流程示意如下:
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
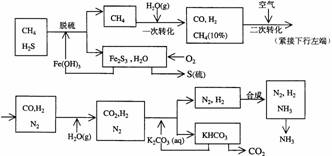
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒夏特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
(此题主要结合化工生产实际,考查无机和有机化学反应的基本知识,以及运用化学平衡移动的原理解决化学实际问题的能力。答题时要看懂天然气合成氨的工艺流程示意意图,结合反应原理加以分析。)
4.化学平衡的有关计算,有相当一类题型“貌似计算,实则可推”,解题的关键往往借用假设法、极值法、途径法、终态法、守恒法、差量法等。
典型题点击
3.关于化学平衡计算的一般思路和方法
建立模式、确定关系、依据题意、列出方程
化学平衡的计算模式:mA(g)+nB(g)  pC(g)+qD(g)
pC(g)+qD(g)
起始浓度(mol/L) a b c d
变化浓度(mol/L) mx nx px qx
平衡浓度(mol/L) a-mx b-nx c+px d+qx
(1)A的转化率=mx/a×100%(量:物质的量、浓度、体积、质量等)
(2)各组分体积分数
 如φ(A)=
如φ(A)=
(3)平均相对分子质量的变化规律

 =
=  如何变化取决于m总和n总的变化情况
如何变化取决于m总和n总的变化情况
(4)气体状态方程的应用
 ①T、V恒定时:
①T、V恒定时:

②T、P恒定时:

③T、P恒定时:
 ④T、P、V恒定时:
④T、P、V恒定时:

⑤T、m、V恒定时:
2.化学平衡原理的应用
(1)适用的平衡:适用于溶解平衡、电离平衡、水解平衡、络合平衡等。
(2)工业上应用:如合成氨工业、硫酸工业、硝酸工业、有机合成等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com