
2.在一固定容积的密闭容器中加入2 L X气体和3 L Y气体,发生如下反应:nX(g)+3Y(g)  2R(g) ;△H<0,反应达平衡时,测知X和Y的转化率分别为30%和60%,则化学方程式中的n值是( )
2R(g) ;△H<0,反应达平衡时,测知X和Y的转化率分别为30%和60%,则化学方程式中的n值是( )
A.1 B.2 C.3 D.4
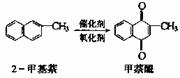
1.甲萘醌(维生素K)有止血作用,它可用2-甲基萘氧 化制得,
反应中常用乙酸做催化剂,该反应放热,可表示为
在某次合成反应中,用1.4g(0.01mol)的2-甲基萘才制得0.17g(0.001 mol)甲萘醌。巳知该次合成反应的速率是快的。导致产率低的原因是( )
A.使用了过量的氧化剂
B.把反应混合物加热
C.没有用乙酸做催化剂而改用其他催化剂
D.所生成的甲萘醌为沉淀物
3.运用气体状态方程解题时,要注意前提条件,否则比例关系错误。
 纠错训练
纠错训练
2.进行有关化学反应速率与化学平衡的计算时,要理清起始量、变化量、平衡量之间关系,易混淆出错。
1.工业生产适宜条件的选择原则
(1)既要注意外界条件对化学反应速率和化学平衡影响的一致性,又要注意对二者影响的矛盾性。
(2)既要注意温度、催化剂对速率影响的一致性,又要注意催化剂的活性对温度的限制。
(3)既要注意理论生产,又要注意实际可能性。
9.在一定条件下,把1molN2、1molH2通到一个容积不变的密闭容器中,发生如下反应:N2十3H2 2NH3,当此反应平衡时,容器内气体压强为P。
2NH3,当此反应平衡时,容器内气体压强为P。
(1)若在上述完全相同的容器中,保持温度不变,通人1/3molNH3,若要使平衡时能使容器内压强仍为P,则需加入N2和H2的物质的量各为多少?
(2)平衡时,N2、NH3的物质的量的范围各是多少?
(3)欲使平衡时,H2和NH3均为1/2mol,你认为是否有可能?
(本题测试学生对化学平衡的定量理解及相关计算的基本技能。答题时要确立等效平衡关系,利用假设法分析推理求之。)
第13课时 化学平衡的应用及计算(B卷)
易错现象
8.试述合成氨工业生产中选择20MPa-50MPa这一压强的理由。为什么在接触法生产硫酸的过程中SO2转化为SO3的反应不采用加压的方法?
(此题考查学生应用速率和平衡移动原理解决实际问题的能力。答题时要理论联系实际,从提高综合经济效益的角度来考虑。)
7.合成氨工业中,原料气(N2、H2及少量CO、NH3)在进入合成塔前用醋酸二氨合铜(Ⅰ)溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3]
[Cu(NH3)3]
Ac·CO;△H<0
(1)必须除去原料气中CO的原因是 。
(2)醋酸二氨合铜(Ⅰ)吸收CO的生产适宜条件应是 。
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的生产适宜条件应是 。
(该题以合成氨工业原料气的处理为依托,考查学生对勒夏特列原理的应用。答题时注意综合考虑多方面的因素。)
6.X、Y、Z为三种气体,把amolX和bmolY充入一密闭容器发生X+2Y 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n (Z),则Y的转化率为( )
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n (Z),则Y的转化率为( )
A.[(a+b)/5]×100% B.[2(a+b)/5b]×100%
C.[2(a+b)/5 ]×100% D.[(a+b)/5a]×100%
(本题考查学生对化学平衡的定量理解及相关的计算能力。答题时要通过建立模式、确定关系、列式求算。)
5.在一个6L的密闭容器中,放入3LX(g)和2LY(g),在一定条件下发生下列反应:4X(g)+3Y(g) 2Q(g)+nR(g) 达到平衡后,容器内温度不变,混和气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是( )
2Q(g)+nR(g) 达到平衡后,容器内温度不变,混和气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是( )
A.3 B.4 C.5 D.6
(该题考查学生对化学平衡知识的掌握情况,同时也考查思维的敏捷性。答题时抓住变化特征,化“计算”为“推断”。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com