
6.解建立计算模式: X + 2Y  2Z
2Z
n始(mol) a b 0
Δn(mol) x 2x 2x
n平(mol) a-x b-2x 2x
据题意:(a-x)mol+(b-2x)mol=2xmol  mol
mol
气体Y的转化率= 故B项正确。
故B项正确。
1.D 2.BD 3.BD 4.D 5.D 6.B
讲析:1.第一步反应:C(s)+H2O(g)
 CO(g)+H2(g) ;△H>0,是吸热反应,降低温度平衡左移;生成的CO量少,不利于提高CO的转化率,故①不对。增大CO 浓度,其转化率也不可能提高。此题选D。 2.应注意化学平衡移动原理和化学反应速率理论的应用范围。B中加催化剂只能提高反应速率。D中合成氨的反应是放热反应,升高温度反应速率加快,平衡左移。 3.寒冷季节易诱发关节疼痛,说明降低温度易形成尿酸钠晶体,则反应②是放热反应,故选BD。 4.平衡气体平均相对分子质量为2×4.25=8.5,而向右反应结果,物质的量增加,平均相对分子减小。根据平衡中可逆反应的不完全转化特征n(A)>
CO(g)+H2(g) ;△H>0,是吸热反应,降低温度平衡左移;生成的CO量少,不利于提高CO的转化率,故①不对。增大CO 浓度,其转化率也不可能提高。此题选D。 2.应注意化学平衡移动原理和化学反应速率理论的应用范围。B中加催化剂只能提高反应速率。D中合成氨的反应是放热反应,升高温度反应速率加快,平衡左移。 3.寒冷季节易诱发关节疼痛,说明降低温度易形成尿酸钠晶体,则反应②是放热反应,故选BD。 4.平衡气体平均相对分子质量为2×4.25=8.5,而向右反应结果,物质的量增加,平均相对分子减小。根据平衡中可逆反应的不完全转化特征n(A)> n(平),故M(A)<2M(平)=17。 5.根据固定体积的密闭容器内温度不变,混合气体的压强增大和“X”浓度减小,可知化学平衡向正反应方向移动,得4+3<2+n,n>5,据选项可知n=6。
n(平),故M(A)<2M(平)=17。 5.根据固定体积的密闭容器内温度不变,混合气体的压强增大和“X”浓度减小,可知化学平衡向正反应方向移动,得4+3<2+n,n>5,据选项可知n=6。
3.(1)正反应,7.0 (2)不相等,因题中有“x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置”,所以当x=4.5时或5.0时,达到平衡的温度一定不同,因平衡条件不同,平衡时A的物质的量一定不同。
讲析:(1)反应器左侧的反应为一个反应前后总体积不变化的反应,总物质的量始终为nA+nB+nC=4mol+4mol+4mol=12mol,这就要求反应器右侧也必须始终保持总的物质的量为12mol。当x=4.5时,右侧反应在起始时总的物质的量为6.5mol+4.5mol+2mol=13mol,大于12mol,此时反应向总体积缩小的方向移动,即向正反应方向进行。由于右侧的正反应是一个体积缩小的反应,E物质参与反应的越多,体积缩小的越多。设平衡时D物质消耗量为amol。
D + 2E  2F
2F
起始时: 6.5 x 2.0
变化量: a 2a 2a
平衡时:6.5-a x-2a 2.0+2a
 解得 x<7.0
解得 x<7.0
新活题网站
2.A、D
讲析:
X(g)+a Y(g)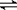 b Z(g)
b Z(g)
反应前物质的量(mol) 1 a 0
反应后物质的量(mol) 1-1×50%=0.5 0.5a 0.5b
反应前气体总物质的量为(1+a)mol
反应后气体总物质的量为(0.5+ 0.5a+0.5b)mol
按定义,密度、质量、体积之间的关系为d=m/V,题设情境气体的总质量m未变,所以气体密度d与体积V成反比,在同温同压下,按照阿伏加德罗定律,V又与气体总物质的量成正比,因此密度与气体总物质的量成反比。据此列式
(1+a):(0.5+ 0.5a+0.5b)=1: ,化简成1+a=2b
,化简成1+a=2b
将选项中的各a、b值代入可见,只有A、D项的等式成立。
1.(1)3H2S+2Fe(OH)3=Fe2S3+6H2O (2)2.7n (3)b
(4)生产纯碱(或作制冷剂等)
 (5)
(5)
13.恒温时,在某密闭容器中通入2molA(g)和1molB(g),发生如下反应:2A(g)+B(g)  2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
(1)与上述平衡保持同温、同压,另取4molA(g)和2molB(g)达平衡,则C的体积分数为多少?平衡时,气体的总物质的量是多少?
(2)在另一密闭容器中,通入n(A) molA(g)和n(B) molB(g),若保持平衡时C的体积分数仍为0.4,则恒有an(B)<n(A)<bn(B),问a、b各为多少?
第13课时 (A卷)
典型题点击
12.在真空密闭容器中加入amolPH4I固体,在一定温度下发生如下反应:PH4I(s) PH3(g)+HI(g)
PH3(g)+HI(g)
4PH3(g) P4(g)+6H2(g)
P4(g)+6H2(g)
2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
以上三个反应建立平衡后,测得HI为bmol,I2(g)为cmol、H2为dmol。求:
(1)平衡后,容器内P4和PH3的物质的量(用代数式表示):n(P4)= ;n(PH3)= 。
(2)a、b、c三者的关系服从a> (填含b、c的代数式)。b、c、d三者的关系服从b> (填含c、d的代数式)。
11.Na2Cr2O7的水溶液存在下列平衡Cr2O72-+H2O
2HCrO4- HCrO4- H++ CrO42-
H++ CrO42-
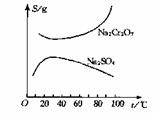 已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示,为把含有少量Na2SO4的Na2Cr2O7晶体提纯,可采取以下方法:①趁热过滤;②用降温法结晶分离出Na2Cr2O7;③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液;④加热至100℃以上蒸发浓缩;⑤加稀H2SO4酸化。
已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示,为把含有少量Na2SO4的Na2Cr2O7晶体提纯,可采取以下方法:①趁热过滤;②用降温法结晶分离出Na2Cr2O7;③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液;④加热至100℃以上蒸发浓缩;⑤加稀H2SO4酸化。
(1)操作步骤的正确顺序是(填序号) 。
(2)用稀H2SO4酸化的目的是
。
(3)实验中趁热过滤的目的是
。
10.在一个与外界不能进行热交换的密闭容器中,反应CaCO3 CaO+CO2在不同温度下CO2的平衡压强如下表:
CaO+CO2在不同温度下CO2的平衡压强如下表:
在不同温度下CO2的平衡压强
|
温度/℃ |
550 |
650 |
750 |
850 |
897 |
|
压强/Pa |
5.32×10 |
9.17×102 |
8.37×103 |
4.94×104 |
1.01×105 |
根据上述数据,完成下列填空:
(1)若升高原CaCO3分解平衡体系的温度,同时给反应容器加压,则原平衡 (填字母)。
A.向逆反应方向移动 B.向正反应方向移动
C.不移动 D.无法确定平衡移动方向
(2)在上述密闭容器中,足量的CaCO3在850℃时建立了平衡。若将该容器的容积扩大为原来的2倍,当重新达到平衡时容器内的温度将 (填“升高”或“降低”)。CaCO3的分解率将 (填“增大”或“减小”),CO2的平衡压强将 4.94×104Pa(填“>”、“<”或“=”),其理由是
。
9.工业上用氨和二氧化碳反应合成尿素:2NH3+CO2=CO(NH2)2+H2O。已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,CO2供合成尿素用。若从充分利用原料的角度考虑,选用 (填序号)物质作原料较好。作出选择的依据是
。
A.CO B.石脑油(C5H12、C6H14)
C.CH4 D.焦炭
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com