
21. (13分)
某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍。A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是 。
(2)已知:
ⅰ. 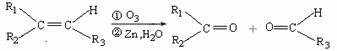 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. 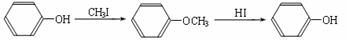
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。
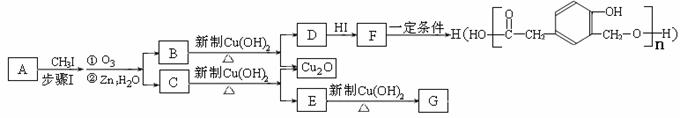
请回答:
① 步骤Ⅰ的目的是 ;
② 若G的相对分子质量是44,则E的结构简式是 ;E的核磁共振氢谱中有 个吸收峰(填数字);③ F→H的反应类型是 ;
④ F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式 ;
⑤ A的结构简式是 ;上述转化中B→D的化学方程式是 。
(3)已知A的某种同分异构体N具有如下性质:
① N与FeCl3反应,溶液呈紫色;
② N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③ 在通常情况下,1molN能与含1molBr2的浓溴水发生取代反应;
④ N分子中苯环上的取代基上无支链。
请写出:N可能的结构简式 (写一种即可)。
崇文区2009-2010学年度第一学期高三期末统一练习
20. (13分)
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
 (1)已知:H-H键能为436 kJ/mol,N N键能为945 kJ/mol,N-H键能为391 kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
(1)已知:H-H键能为436 kJ/mol,N N键能为945 kJ/mol,N-H键能为391 kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下该反应的化学平衡常数K= ;反应达到平衡后,保持温度、容积不变,若向平衡体系中加入0.4 mol N2 、 1 mol H2和0.2 mol NH3 ,化学平衡将
向 方向移动(填“正反应”或“逆反应”)。
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:

① 向沉淀池中加入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是 。操作Ⅰ的名称是 。
② 煅烧炉中产生的固态副产品为 ,生产流程中能被循环利用的物质X为 。
19. (14分)
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
|
元素 |
结构或性质 |
|
A |
原子最外层电子数是内层电子总数的1/5 |
|
B |
形成化合物种类最多的元素,其单质为固体 |
|
C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
|
D |
地壳中含量最多的元素 |
|
E |
与D同主族 |
|
F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是 ;A与E形成的化合物的电子式是 。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是 。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是 。
(4)F的盐酸盐水溶液呈酸性,原因是 (用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是 。
 (5)A与F形成的合金是重要的工业材料。某同学仅使用天平和右图所示的装置,粗略
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和右图所示的装置,粗略
测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b。
a是 ;
b是 。
②合金中A元素的质量分数是 (用含m、a、b的式子表示)。
18.(10分)
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3 kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。a. 2C2H6 -14 e- +7O2 === 4CO2 + 6 H2O
b. C2H6 -14 e- + 18 OH- === 2 CO32- + 12 H2O
 c. O2 + 2H2O + 4 e-
=== 4OH-
c. O2 + 2H2O + 4 e-
=== 4OH-
d. O2- 4 e- + 4H+ === 2H2O
(3)在右图所示实验装置中,石墨棒上的电极反应式为 ;如果起始 时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
17.(10分)
高锰酸钾是锰的重要化合物和常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。请回答下列问题:
(1)通常高锰酸钾保存在棕色试剂瓶中,下列试剂不需要用棕色试剂瓶保存的是 (填字母代号)。
a. 浓硝酸 b. 氯水 c. 烧碱
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质不同的是 (填字母代号)。
a. 84消毒液(主要成分是NaClO) b. 75%酒精
c. 臭氧 d. 双氧水
(3)写出MnO2催化H2O2溶液制氧气的化学方程式 。
(4)在用软锰矿制备高锰酸钾的生产中需要纯净的CO2气体。
① 若实验室要制备纯净的CO2,从下列给出的试剂中最好选择 (填字母代号)。
a. 石灰石 b. 浓盐酸 c. 稀硫酸 d. 纯碱
② 与上述所选试剂对应的气体发生装置是 (填字母代号)。

(5)①通常状况下,酸性高锰酸钾溶液不能与下列物质中的 反应(填字母代号)。
a. 乙醇 b. Na2SO3溶液 c. 环己烯 d. 苯 e. FeSO4溶液
②将用稀硫酸酸化的高锰酸钾溶液滴入盛有足量草酸溶液的试管中,振荡后,观察到的现象是 。已知1mol草酸参加反应时转移的电子数是2×6.02×1023,锰元素在生成物中的化合价为+2。请写出此反应的化学方程式 。
16.将11.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是
A.0.3mol NO2 和0.3mol NO B.0.2mol NO2和0.1mol N2O4
C.0.1mol NO、0.2mol NO2和0.05mol N2O4 D.0.6mol NO
第Ⅱ卷(非选择题 共60分)
15. 反应A2+B2
反应A2+B2 2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;
2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;
c为300℃时,从t3时刻开始向容器中加压的情况。则下列叙述正确的是
A. A2、B2、AB均为气体,正反应放热
B. AB为气体,A2、B2中最少有一种为非气体,正反应放热
C. AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D. AB为液体,A2、B2中最少有一种为非气体,正反应吸热
14. 著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。
已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
A. 铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4
+ 2H2↑
CeI4
+ 2H2↑
B. 在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
C. 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ == Ce3+ + 2Fe3+
D. 四种稳定的核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同系物
13. 右图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是
右图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是
A.非金属性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.三种元素中,Y的最高价氧化物对应的水化物酸性最强
12. 根据下列实验内容得出的结论正确的是
|
选项 |
实验内容 |
结论 |
|
A |
某物质的水溶液能使红色石蕊试纸变蓝 |
该物质一定是氨气 |
|
B |
某气体能使湿润的淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
|
C |
某物质的水溶液中加入盐酸产生无色无气味气体 |
该溶液一定含有大量碳酸根离子 |
|
D |
向铁和稀硝酸反应后的溶液中滴加KSCN溶液,溶液显红色 |
反应后溶液中肯定有Fe3+,可能还有Fe2+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com