
1.识图方法: 一轴 二线 三斜率 四面积 五截距 六交点
3.离心运动
在向心力公式Fn=mv2/R中,Fn是物体所受合外力所能提供的向心力,mv2/R是物体作圆周运动所需要的向心力。当提供的向心力等于所需要的向心力时,物体将作圆周运动;若提供的向心力消失或小于所需要的向心力时,物体将做逐渐远离圆心的运动,即离心运动。其中提供的向心力消失时,物体将沿切线飞去,离圆心越来越远;提供的向心力小于所需要的向心力时,物体不会沿切线飞去,但沿切线和圆周之间的某条曲线运动,逐渐远离圆心。
●力学模型及方法
2.解决匀速圆周运动问题的一般方法
(1)明确研究对象,必要时将它从转动系统中隔离出来。
(2)找出物体圆周运动的轨道平面,从中找出圆心和半径。
(3)分析物体受力情况,千万别臆想出一个向心力来。
(4)建立直角坐标系(以指向圆心方向为x轴正方向)将力正交分解。
(5)
5、光线以入射角i斜射入一块两面平行的折射率为n、厚度为h的玻璃砖后,出射光线仍与入射光线平行,但存在侧移量 △
△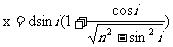 两反射光间距
两反射光间距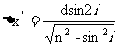
双缝干涉: 条件f相同,相位差恒定(即是两光的振动步调完全一致) 当其反相时又如何?
 亮条纹位置: ΔS=nλ; 暗条纹位置:
亮条纹位置: ΔS=nλ; 暗条纹位置: 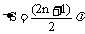 (n=0,1,2,3,、、、);
(n=0,1,2,3,、、、);
条纹间距 :
(ΔS :路程差(光程差);d两条狭缝间的距离;L:挡板与屏间的距离) 测出n条亮条纹间的距离a 薄膜干涉:由膜的前后两表面反射的两列光叠加,实例:肥皂膜、空气膜、油膜、牛顿环、光器件增透膜
(厚度是绿光在薄膜中波长的1/4,即增透膜厚度d=λ/4) 衍射:现象,条件 单缝 圆孔 柏松亮斑(来历) 任何物体都能使光发生衍射致使轮廓模糊
三种圆环区别:单孔衍射(泊松亮斑) 中间明而亮,周围对称排列亮度减弱,条纹宽变窄的条纹
 空气膜干涉环 间隔间距等亮度的干涉条纹
空气膜干涉环 间隔间距等亮度的干涉条纹


 牛顿环
内疏外密的干涉条纹
牛顿环
内疏外密的干涉条纹
干涉、衍射、多普勒效应(太阳光谱红移 宇宙在膨胀)、偏振都是波的特有现象,证明光具有波动性;衍射表明了光的直线传播只有一种近似规律;说明任何物理规律都受一定的条件限制的.
宇宙在膨胀)、偏振都是波的特有现象,证明光具有波动性;衍射表明了光的直线传播只有一种近似规律;说明任何物理规律都受一定的条件限制的.
光的电磁说⑴麦克斯韦根据电磁波与光在真空中的传播速度相同,提出光在本质上是一种电磁波--这就是光的电磁说,赫兹用实验证明了光的电磁说的正确性。
⑵电磁波谱。波长从大到小排列顺序为:无线电波、红外线、可见光、紫外线、X射线、γ射线。各种电磁波中,除可见光以外,相邻两个波段间都有重叠。
|
|
无线电波 |
红外线 |
可见光 |
紫外线 |
X射线 |
n射线 |
|
|
组成频率波 |
波长:大 小 波动性:明显 小 波动性:明显 不明显 不明显频率:小  大 粒子性:不明显 大 粒子性:不明显 明显 明显 |
||||||
|
产生机理 |
在振荡电路中,自由电子作周期性运动产生 |
原子的外层电子受到激发产生的 |
原子的内层电子受到激发后产生的 |
原子核受到激发后产生的 |
|||
⑶红外线、紫外线、X射线的主要性质及其应用举例。
|
种 类 |
产 生 |
主要性质 |
应用举例 |
|
红外线 |
一切物体都能发出 |
热效应 |
遥感、遥控、加热 |
|
紫外线 |
一切高温物体能发出 |
化学效应 |
荧光、杀菌、合成VD2 |
|
X射线 |
阴极射线射到固体表面 |
穿透能力强 |
人体透视、金属探伤 |
⑷实验证明:物体辐射出的电磁波中辐射最强的波长λm和物体温度T之间满足关系λm T = b(b为常数)。可见高温物体辐射出的电磁波频率较高。在宇宙学中,可根据接收恒星发出的光的频率,分析其表面温度。
光五种学说:原始微粒说(牛顿),波动学说(惠更斯),电磁学说(麦克斯韦),
光子说(爱因斯坦),波粒两相性学说(德布罗意波)概率波
各种电磁波产生的机理,特性和应用,光的偏振现象说明光波是横波,也证明光的波动性.
激光的产生特点应用(单色性,方向性好,亮度高,相干性好)
光电效应实验装置,现象,所得出的规律(四)爱因斯坦提出光子学说的背景
爱因斯坦光电效应方程:mVm2/2=hf-W0一个光子的能量E=hf (决定了能否发生光电效应)
光电效应规律:实验装置、现象、总结出四个规律
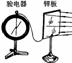 ①任何一种金属都有一个极限频率,入射光的频率必须大于这个极限频率,才能产生光电效应;低于这个极限频率的光不能产生光电效应。
①任何一种金属都有一个极限频率,入射光的频率必须大于这个极限频率,才能产生光电效应;低于这个极限频率的光不能产生光电效应。
②光电子的最大初动能与入射光的强度无关,只随入射光频率的增大而增大。
③入射光照到金属上时,光子的发射几乎是瞬时的,一般不超过10-9s
④当入射光的频率大于极限频率时,光电流强度与入射光强度成正比。
康普顿效应(石墨中的电子对x射线的散射现象)这两个实验都证明光具粒子性 光波粒二象性:
?情况体现波动性(大量光子,转播时,λ大),
?粒子性 光波是概率波(物质波) 任何运动物体都有λ与之对应(这种波称为德布罗意波)
原子和原子核:汤姆生发现电子从而打开原子的大门,枣糕式原子模型,
卢瑟福α粒子散射实验装置,现象,从而总结出核式结构学说
而核式结构又与经典的电磁理论发生矛盾①原子是否稳定,②其发出的光谱是否连续
玻尔补充三条假设
定态----原子只能处于一系列不连续的能量状态(称为定态),电子虽然绕核运转,但不会向外辐射能量.
跃迁----原子从一种定态跃迁到另一种定态,要辐射(或吸收)一定频率的光子
(其能量由两定态的能量差决定)
能量和轨道量子化----定态不连续,能量和轨道也不连续;(即原子的不同能量状态跟电子沿不同的圆形轨道绕核运动相对应,原子的定态是不连续的,因此电子的可能轨道分布也是不连续的)
光子的发射与吸收(特别注意跃迁条件):原子发生定态跃迁时,要辐射(吸收)一定频率的光子:hf=E初-E末 氢原子的激发态和基态的能量(最小)与核外电子轨道半径间的关系是:En=E1/n2,rn=n2r1,
其中E1=-13.6eV, r1=5.3×10-10m,
(大量)处于n激发态原子跃迁到基态时的所有辐射方式共有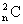 =n (n-1)/2种
=n (n-1)/2种
E51=13.06 E41=12.75 E31=12.09 E21=10.2; (有规律可依)
E52=2.86 E42=2.55 E32=1.89; E53=0.97 E43=0.66; E54=0.31
氢原子在n能级的动能、势能,总能量的关系是:EP=-2EK,E=EK+EP=-EK。(类似于卫星模型)
 由高能级到低能级时,动能增加,势能降低,且势能的降低量是动能增加量的2倍,故总能量(负值)降低。
由高能级到低能级时,动能增加,势能降低,且势能的降低量是动能增加量的2倍,故总能量(负值)降低。
 量子数
量子数
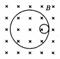
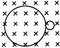
核变化从贝克勒耳发现天然放射现象开始衰变(用电磁场研究):
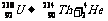
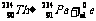
α衰变形成外切(同方向旋),β衰变形成内切(相反方向旋),且大圆为α、β粒子径迹。
αβ衰变的实质 β衰变是核内的中子转变成了质子和中子
 半衰期(由核决定,与物理和化学状态无关)、 同位素等重要概念 放射性标志
半衰期(由核决定,与物理和化学状态无关)、 同位素等重要概念 放射性标志
质子的发现(卢瑟福)用α粒子轰击氮核,并预言中子的存在.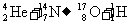
中子的发现(查德威克)钋产生的α射线轰击铍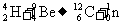
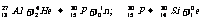 正电子的发现(约里奥居里和伊丽芙居里夫妇)α粒子轰击铝箔
正电子的发现(约里奥居里和伊丽芙居里夫妇)α粒子轰击铝箔
四种核反应变化(衰变,人工核转变,重核裂变,轻核骤变)
4、由水面上看水下光源时,视深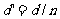 ;若由水面下看水上物体时,视高
;若由水面下看水上物体时,视高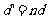 。
。
3、光线由真空射入折射率为n的介质时,如果入射角θ满足tgθ=n,则反射光线和折射光线一定垂直。
2、两相互正交的平面镜构成反射器,任何方向射入某一镜面的光线经两次反射后一定与原入射方向平行反向。
30. ⑴ 羧基(1分) 羟基(1分) C7H10O7(2分)
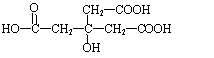 ⑵
⑵
(3分)


(3分)
⑶
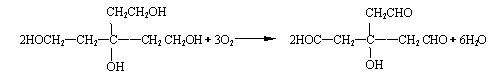
(2分)
⑷
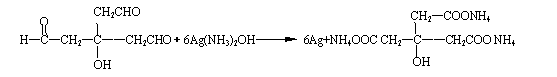
+9NH3+3H2O
(3分)[
29.
Ⅰ(1)否 (1分) KMnO4溶液自身可做指示剂(1分)(2)90%(2分)
(3)SO3(g)+H2O(l)====H2SO4(l); △H=-130.3kJ· mol-1 (3分)
Ⅱ⑴xCH4+4NOx=2N2+xCO2+2xH2O (2分) 2:3(2分) (2)3.25(2分)
4ZnFe2O4+3H2 4ZnFeO 3.25+3H2O(2分)
4ZnFeO 3.25+3H2O(2分)
28. ⑴ 0(ⅦA也给分)(2分) MnO2+4HCl MnCl2+Cl2↑+H2O(2分)
MnCl2+Cl2↑+H2O(2分)
⑵ H++Al(OH)3===Al3++3H2O
H++OH-=== H2O
Al(OH)3+OH-===AlO2-+2H2O(3分)
 ⑶ N N (2分)Na3N (2分)(NaN3也给分) 离子晶体(1分)
⑶ N N (2分)Na3N (2分)(NaN3也给分) 离子晶体(1分)
⑷ 不变(1分) 增大(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com