
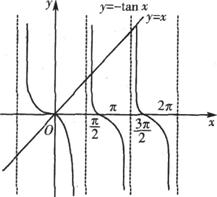
6.若点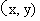 在不等式组
在不等式组 表示的平面区域内运动,
表示的平面区域内运动,
则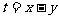 的取值范围是
的取值范围是

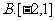
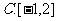
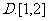
5.“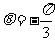 ”是“
”是“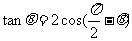 ”的
”的
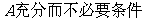
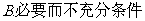
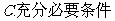
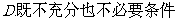
4.定义在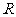 上的函数
上的函数 是奇函数又是以
是奇函数又是以 为周期的周期函数,则
为周期的周期函数,则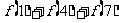 等于
等于

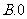
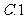
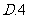
3.函数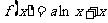 在
在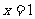 处取到极值,则
处取到极值,则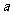 的值为
的值为
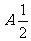
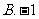
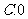
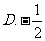
2.计算 的结果是
的结果是
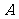
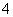
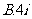
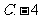
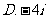
1.设全集R,M=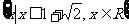 ,N=
,N=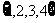 ,则
,则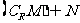 等于
等于
A.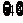 B.
B.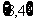 C.
C.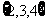 D.
D.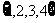


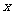 |
 |
 |
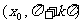 |
|
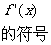 |
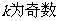 |
- |
0 |
+ |
 |
+ |
0 |
- |

(二)非选择题
24.本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答8题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
(1)现有下列物质:维生素A、维生素C、碘元素、铁元素、淀粉、油脂。请选择正确答案填在相应的空格里。
①人体缺乏某种维生素会引起坏血病,这种维生素是 。
②人体缺乏某种微量元素会发生贫血,这种微量元素是 。
③既能为人体提供热量,又能提供必需脂肪酸的物质是 。
[解析]本题为填空型选择题,以人体必需的营养物质为题材,考查维生素、微量元素、油脂的水解产物等知识。本题属于容易题。
(一)单项选择题
1.全球气候在变暖。据报道,江苏在最近47年里平均气温升高1.38 ℃。下列哪种气体的增加是导致这种情况出现的主要原因
A.N2 B.O2 C.C02 D.S02
[解析]本题以新闻报道为背景材料,考查学生对元素化合物知识的理解应用,同时注意对学生加强环境保护的情感教育。本题属于容易题。
大气中的二氧化碳气体能像温室的玻璃或塑料薄膜那样,使地面吸收的太阳光的热量不易散失,从而使全球变暖,这种现象叫“温室效应”。能产生“温室效应”的气体还有臭氧(03)、甲烷、氟氯代烷等。
[答案]C
2.“垃圾是放错了位置的资源”,应分类回收利用。生活中废弃的塑料制品、旧轮胎、废纸等属于
A.单质 B.有机物 C.氧化物 D.无机物
[解析] 本题要求学生根据物质的组成和性质对物质进行分类,既考查相关的化学概念,又考查对常见有机物组成的理解,同时进行环境保护教育。本题属于容易题。
单质是指由同一种元素组成的纯净物;无机物通常是指不含碳元素的化合物;有机物是指含碳元素的化合物(少数含碳的化合物,如一氧化碳、二氧化碳和碳酸钠等碳酸盐具有无机化合物的特点,因此把它们看作无机化合物);氧化物是由氧元素和另一种元素组成的化合物。塑料制品、旧轮胎、废纸都是含碳、氢等元素的有机物。
[答案]B
3.下列物质敞口放置不会对空气造成污染的是
A.食盐 B.浓盐酸 C.苯 D.浓硝酸
[解析] 本题选取学生熟知的食盐、浓盐酸、苯和浓硝酸为材料,设置敞口放置的情景,考查学生对相关物质性质的了解,在某种程度上既考查学生对实验室化学试剂保存方法的了解情况,又渗透了环境保护意识。本题属于容易题。
常温下食盐不挥发,敞口放置不会对空气造成污染。而浓盐酸、苯、浓硝酸都具有挥发性,敞口放置会对空气造成污染。
[答案]A
4.下列气体中不能用浓硫酸干燥的是
A.O2 B.C02 C.NH3 D.S02
[解析]本题从气体干燥角度将有关物质的性质串联起来,考查浓硫酸具有酸的通性和氧化性、吸水性等特性,以及四种气体的性质。本题属于容易题。
02、CO2、S02等气体不与浓硫酸发生反应,可以用浓硫酸进行干燥。而NH。能与浓硫酸发生反应生成铵盐,因此,不能用浓硫酸干燥。
[答案]C
5.常温下,铁与下列酸溶液作用产生H2的是
A.浓硫酸 B.稀硫酸 C.浓硝酸 D.稀硝酸
[解析]本题以铁与酸置换反应产生氢气立意,考查学生对硫酸、硝酸性质的了解,将初中化学与高中化学知识有机结合起来,体现了知识的发展性和化学学习的阶段性要求。本题属于容易题。
浓硫酸、浓硝酸和稀硝酸具有强氧化性,常温下浓硫酸、浓硝酸能使铁表面氧化为致密的氧化物薄膜,这层薄膜阻止酸与内层金属进一步反应。稀硝酸与铁反应生成N0气体,不能生成氢气。
[答案]B
6.下列化学用语表示正确的是
A.氯化钙的化学式CaCl
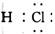 B.HCl分子的电子式
B.HCl分子的电子式
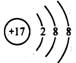 C.乙烯的结构简式CH2CH2
C.乙烯的结构简式CH2CH2
D.氯原子的结构示意图
[解析] 化学用语既是学习化学的基本工具,同时也是表达化学知识的必备工具。本题以高中化学常见的化学式、结构示意图、电子式、结构简式为命题点,让学生判断相关化学用语的正误。本题属于容易题。氯化钙的化学式为CaCl2;乙烯的结构简式为CH2=CH2;氯原子的结构示意图为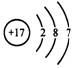
[答案]B
7.欲配制浓度为1.00 mol/L的氯化钠溶液l00 mL,用不到的仪器是
A.容量瓶 B.分液漏斗 C.玻璃棒 D.烧杯
[解析] 本题以物质的量浓度的配制这一重要实验为例,考查相关实验仪器的选择,同时考查实验过程与方法目标的达成度,引导中学开展积极有效的实验教学。本题属于容易题。
用固体试剂配制一定物质的量浓度的溶液,需要经过称量、溶解、转移、定容等操作,必须使用的仪器有天平(分析天平或电子天平)、烧杯、玻璃棒、容量瓶、滴管等。不需使用分液漏斗。
[答案]B
8.下列分散系能产生丁达尔效应的是
A.硫酸铜溶液 B.稀硫酸 C.溴水 D.氢氧化铁胶体
[解析] 本题以胶体概念立意,考查学生对常见物质形成的溶液和胶体等分散系概念的理解,知道“丁达尔效应”是鉴别胶体和溶液的一种简便的方法,体会化学研究中物质的多种分类方法。本题属于容易题。
本题中的硫酸铜溶液、稀硫酸、澳水都是溶液,不会产生丁达尔现象。
[答案]D
9.下列离子在溶液中可以大量共存的一组是
A.H+、Na+、0H- B.Na+、NO3-、Cl- C.K+、H+、HCO3- D.Ca2+、SO42-、CO32-
[解析]离子共存题是一种基本题型,通过对溶液中四组离子能否大量共存的判断,考查学生对离子反应发生条件的认识。本题属于容易题。
溶液中的离子若能相互反应生成沉淀、气体或水等,在溶液中就不能够大量共存。选项A中,H+与OH-能反应生成水;选项C中,H+与HCO3-能发生反应生成C02气体和水;选项D中,Ca2+与C032-能形成CaC03沉淀,与SO42-能形成微溶的CaS04。因此,A、C、D三组离子在溶液中都不能大量共存。选项B中,Na+、N03-、Cl-相互之间不能反应,可以大量共存。
[答案]B
10.光导纤维已成为信息社会必不可少的高技术材料。下列物质用于制造光导纤维的是
A.金刚石 B.大理石 C.铝合金 D二氧化硅
[解析] 本题考查的是制造信息社会必不可少的高技术材料--光导纤维的原料,突出在无机非金属材料中,硅及其化合物是密切联系化学与生活的一类重要物质,扮演着重要的角色。本题属
于容易题。纯净的二氧化硅是现代光学及光纤制品的基本原料。
[答案]D
11.“脚印” 、“笑脸”、“五环”等焰火让北京奥运会开幕式更加辉煌壮观,这些五彩缤纷的焰火与元素的焰色反应有关。下列说法错误的是
A.观察K2S04的焰色应透过蓝色的钴玻璃
B.Na和NaCl在灼烧时火焰颜色相同
C.可以用焰色反应来区别NaCl和KCl
D.焰色反应一定发生化学变化
[解析]本题以北京奥运会开幕式“脚印”、“笑脸”、“五环”等辉煌壮观的焰火为背景,考查焰色反应的有关知识,试题具有鲜明的时代性,能够很好地引导学生用化学的视角认识社会和观察生活,引导学生自觉地从国家大事中思考与化学学习的联系,也是对学生进行爱国主义教育的好素材。本题属于容易题。
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。灼烧一些稳定的金属化合物(如NaCl等)发生焰色反应时,化合物本身并没有变成其他物质,亦即没有发生化学反应。钠及其化合物的焰色反应火焰呈黄色,钾及其化合物的焰色反应火焰呈紫色,可以利用焰色反应来区别钠、钾及其化合物。在观察钾及其化合物的火焰颜色时,为了滤去黄色的光,避免微量钠盐的干扰,要透过蓝色钴玻璃观察火焰的颜色。
[答案]D
12.下列离子方程式中,错误的是
A.钠与水反应:Na+H20=Na++OH-+H2↑
B.盐酸与氢氧化钾溶液反应:H++OH-=H2O
C.铁与稀硫酸反应:Fe+2H+=Fe2++H2↑
D.氯化钠溶液与硝酸银溶液反应:Ag++C1-=AgCl↓
[解析]本题通过离子方程式的正误判断,考查学生对钠与水反应等常见化学反应本质的认识以及书写离子方程式的能力。本题属于容易题。
书写离子方程式必须遵循质量守恒、电荷守恒、氧化还原反应电子得失总数相等。A中的离子方程式没有配平,不符合质量守恒定律,根据电子得失总数相等进行配平,正确的离子方程式为:2Na+
2H20=2Na++20H-+H2↑。
[答案]A
13.下列反应属于氧化还原反应的是
A.H2S04+2NaOH=Na2SO4+2H20
B.2NaHC03 Na2C03+C02↑+H20
Na2C03+C02↑+H20
C.NH3+HCl=NH4Cl
D.CuO+H2 Cu+H20
Cu+H20
[解析]本题以常见的四个基本反应为例,考查学生对氧化还原反应概念及其判别方法的掌握情况,渗透四种基本反应类型与氧化还原反应的关系及化学反应的不同分类方法。本题属于容易题。
从化合价是否变化的角度分析,A、B、C三个反应中元素的化合价都没有变化,只有D反应中元素的化合价发生了变化,属于氧化还原反应。
[答案]D
14.下列实验操作中,不能用于物质分离的是
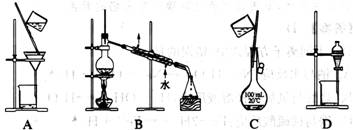
[解析] 本题选取中学化学实验中常见的基本实验操作为素材,考查学生对常见物质分离实验原理和操作方法的理解情况,体现实验方法是化学学习的一种基本方法,引导中学积极开展有效的实验教学。本题属于容易题。
A是过滤操作,可用来分离固体与液体。B是蒸馏操作,可用来分离沸点不同的液体混合物。C是配制一定物质的量浓度溶液的操作。D是分液操作,可用来分离互不相溶的液体混合物。
[答案]C
15.146C常用于测定动植物标本的年龄。关于146C原子的说法正确的是
A.中子数为14 B.质子数为14 C.核外电子数为14 D.质量数为14
[解析] 本题以具有放射性的14C原子为问题情景,考查学生对原子结构知识的理解运用情况,特别是构成原子的各微粒间的数量关系。本题属于容易题。
146C原子的质子数为6,核外电子数也为6。中子数=质量数=质子数,质量数为l4,所以中子数为8。
[答案]D
16.下列物质中含有自由移动的Cl-的是
A.KCl03固体 B.Cl2 C.HCl气体 D.KCl溶液
[解析] 本题以自由移动的Cl-为切入口,将电解质的有关知识综合起来,考查学生对离子键、共价键、离子化合物、共价化合物和电离等知识的理解情况。本题属于容易题。
A为固体,B、C为气体,均不能电离产生自由移动的Cl-。KCl是离子化合物,溶于水时电离产生自由移动的K+和Cl-
[答案]D
17.实验室用锌粒与2 mol/L硫酸溶液制取氢气,下列措施不能增大化学反应速率的是
A.将锌粒换成锌粉
B.改用3 mol/L硫酸溶液
C.改用热的2 mol/L硫酸溶液
D.向该硫酸溶液中加入等体积的水
[解析]本题以制备氢气实验为问题情景,考查学生对化学反应速率理论以及影响化学反应速率的因素的了解,同时让学生体会化学知识在解决问题中的作用。本题属于容易题。
增大反应物浓度(B)、升高温度(C)、使用催化剂、增大固体表面积(A)都能够增大化学反应速率。减小反应物浓度(D)、降低温度能够减小化学反应速率。
[答案]D
18.关于化学反应与能量的说法正确的是
A.中和反应是吸热反应
B.燃烧属于放热反应
C.化学键断裂放出能量
D.反应物总能量与生成物总能量一定相等
[解析] 本题考查化学反应与能量的关系,检测学生对物质燃烧和中和反应中热量变化等常识性知识的了解,并从化学键层面考查学生对化学反应中能量变化本质原因的理解。本题属于容易题。
中和反应、燃烧反应都是放热反应。化学键断裂要吸收能量。反应物总能量与生成物总能量不一定相等,这是化学反应常伴随着能量变化的原因。
[答案]B
19.下列物质可用来鉴别乙酸溶液和乙醇的是
A.稀盐酸 B.水 C.氯化钠溶液 D.碳酸钠溶液
[解析]本题通过对乙酸溶液和乙醇的鉴别,考查学生对乙酸和乙醇结构与性质的差异的了解,加深对官能团是决定有机物化学特性的原子或原子团概念的认识,体现“结构决定性质”这一基本的化学学科思想。本题属于容易题。
乙醇的官能团是羟基(-OH),不显酸性。乙酸的官能团是羧基(-COOH),具有酸的通性。稀盐酸、水、氯化钠溶液、碳酸钠溶液四种物质与乙醇能互溶且都不发生反应;前三种物质与乙酸溶液能互
溶且不发生反应,而碳酸钠溶液与乙酸溶液能发生反应生成气体。因此,可以用碳酸钠溶液来鉴别乙酸溶液和乙醇。
[答案]D
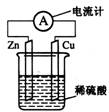 20.右图为铜锌原电池示意图,下列说法正确的是
20.右图为铜锌原电池示意图,下列说法正确的是
A.锌片逐渐溶解
B.烧杯中溶液逐渐呈蓝色
C.电子由铜片通过导线流向锌片
D.该装置能将电能转变为化学能
[解析]本题通过典型的铜锌原电池装置,考查学生对原电池工作原理的理解,认识化学能与电能的相互转化。本题属于中等难度题。
图示原电池中,Zn比Cu的金属活动性强,Zn是负极,Cu是正极。Zn失去电子,被氧化成Zn2+进入溶液,锌片逐渐溶解,电子由锌片通过导线流向铜片,铜片本身不溶解,溶液中的H+从铜片获得电子被还原成氢原子,氢原子再结合成氢分子从铜片上逸出。可见,原电池将化学能转变为电能。溶液中含有Zn2+(无色),不含Cu2+,故溶液不会逐渐呈蓝色。
[答案]A
21.下列反应中属于加成反应的是
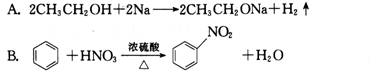
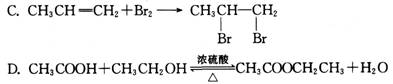
[解析]本题以各类典型有机物及化学反应类型为素材,考查学生对有机反应类型概念的理解情况。本题属于容易题。
反应A属于置换反应,反应B和D都属于取代反应,反应C属于加成反应。
[答案]C
22.X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是
内层电子数的3倍,下列说法中正确的是
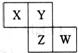 A.X的气态氢化物比Y的稳定
A.X的气态氢化物比Y的稳定
B.w的最高价氧化物对应水化物的酸性比2的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
[解析]本题以元素周期表为背景,考查元素周期律中同周期、同主族等元素金属性和非金属性的递变规律,考查学生对金属性和非金属性内涵的理解运用,同时还考查了相关的元素化合物知识。本题的考查有利于引导学生加强对中学化学主干知识和核心概念的学习。本题属于中等难度题。
Y原子的最外层电子数是内层电子数的3倍,其内层只能是第一电子层,容纳2个电子,最外层即第二电子层的电子数为6,Y是氧元素。根据元素周期表可以推知,X是氮元素,Z是硫元素,W是氯元素。
[答案]B
23.在硫酸铝、硫酸钾和明矾[KAl(S04)2·12H2O]的混合溶液中,S042-的浓度为0.4 mol/L,当加入等体积0.4 mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A.0.225 mol/L B.0.25 mol/L C.0.45 mol/L D.0.9 mol/L
[解析]本题考查了一些典型物质的化学性质及离子浓度的计算技能,对思维的变通性和灵活性有较高的要求,体现了对思维品质的甄别。本题属于较难题。
设KOH溶液的体积为V
A13++40H-= AlO2-+2H20
c(A13+)=1/4 c(OH-)=O.1 mol/L
在硫酸铝、硫酸钾和明矾[KAI(S04)2·l2H20]的混合溶液中,电荷守恒关系式为:
3c(A13+)+ c (K+)=2c(S042-)
c(K+)=2c(S042-)-3c(A13+)=2×0.4 mol/L-3×0.1 mol/L=O.5 mol/L
反应后溶液中K+的浓度约为:
(V×0.5 mol/L+V×0.4 mol/L)/(2V)=O.45 mol/L
[答案]C
(三)试卷满分值
100分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com