
20、(10分)已知A. B. C分别是。CuSO4. FeSO4. AlCl3三种化合物中的一种,向它们的水溶液中分别滴加NaOH溶液到过量,反应现象如下:
①A+NaOH → 白色沉淀,在空气放置,沉淀由白色转化为红褐色。
②B+NaOH → 蓝色沉淀
③C+NaOH → 白色沉淀,继续加入NaOH溶液,白色沉淀逐渐消失。
(1)A、B、C三种物质的化学式为 , , 。
(2)写出步骤③中发生的离子反应方程式;
19、(8分)(1)分别写出下列物质的电离方程式;
 ①氢氧化钡:
①氢氧化钡:
②醋酸:
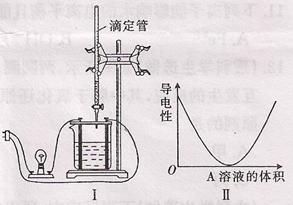
(2)在图I所示的装置中,烧杯内盛放的Ba(OH)2溶液,
当通过滴定管向烧杯中逐渐滴加某溶液时
A时,烧杯中溶液的导电性的变化趋势如图II所表示。
试根据离子反应的特点分析:溶液A中可能含有的溶质可能是
(填化学式),对应反应的离子方程式 。
18、 (8)分硫是钢中的用害杂质,能使钢产生“热脆”性,钢中的含硫量越低,钢的质量越好。碳素钢按钢中硫的含量划分质量等级:普通碳钢含硫0.035%--0.05%;优质碳钢含硫003%--0.035%;高优质碳钢0.02%--0.03%。在化学分析中,常用碘滴定法来测定钢铁中硫的含量,方法是将钢样在将近1300.C的燃烧管中通O2燃烧,使钢铁中的硫转化为SO2,SO2被含有淀粉的水溶液吸收,在用标准碘溶液来滴定,其反应的离子方程式:
(8)分硫是钢中的用害杂质,能使钢产生“热脆”性,钢中的含硫量越低,钢的质量越好。碳素钢按钢中硫的含量划分质量等级:普通碳钢含硫0.035%--0.05%;优质碳钢含硫003%--0.035%;高优质碳钢0.02%--0.03%。在化学分析中,常用碘滴定法来测定钢铁中硫的含量,方法是将钢样在将近1300.C的燃烧管中通O2燃烧,使钢铁中的硫转化为SO2,SO2被含有淀粉的水溶液吸收,在用标准碘溶液来滴定,其反应的离子方程式:
I2 + SO2 + 2H2O = 2I- + SO42- + 4H+。
(1)如图为本实验中滴定管的两种图示,
其中正确的是 (填字母)
(2)上述滴定反应的还原剂是 (填化学式)
(3)称取500mg被测钢样,用6.25* 10-4mol/L的标准碘溶液进行碘滴定,,记录滴定前后滴定管内液面的刻度。重复两次实验,记录所得数据如下表所示。
|
滴定次数 |
滴定管内液面的刻度 |
|
|
滴定前的刻度(ml) |
滴定前后的刻度(ml) |
|
|
1 |
1.03 |
8.06 |
|
2 |
1.00 |
8.00 |
|
3 |
0.60 |
7.57 |
则被测钢样中含硫的质量分数为 ,该钢样属于 (填“普通碳钢”、“优质碳钢”或“高优质碳钢”)
17、(10分)某实验小组的同学为探究一氧化氮的性质,想用下列实验装置来制取一氧化氮。

请回答下列问题:
(1)用如图所示的装置制取并收集NO,选用的仪器装置的连接顺序应是A接
(填“B”,“C”或“D”)
(2)稀硝酸具有强氧化性,在常温下就可以与铜发生反应生成NO,写出该反应的化学方程式 ;在实验过程中,该小组的同学采用了微热的方式,目的是 。
(3)实验开始时,该小组的同学发现在圆底烧瓶中有红棕色的气体产生,请你用化学方程式来表示产生这种现象的原因:
16、燃料电池是一种新型能源,由于其电极材料丰富,电解质多种多样,燃料电池将渗透到我们生活中的各个领域(如图a的燃料电池汽车)。最常见的是氢氧燃料电池(如图b),其中的隔膜只允许离子和水分子通过,不允许气体分子通过。下列有关图b所示的氢氧燃料电池的叙述中正确的是
A,通人H2一端的Pt丝为电池的正极,通人O2一端的Pt丝为电池的负极
B.电池负极的电极反应式为H2+20H--2e == 2HzO
C已电池正极的电极反应式为40H-- - 4e-=2H20 + O2↑
D.电池工作一段时间后,电解质溶液的pH变大
第II卷(非选择题,共52分)
15、将25°C、0.1 mol. L-1的下列各物质的水溶液加热至80°C C溶液体积变化忽略不计),溶液 的pH保持不变的是
 A,H2S04 B.
NaOH C.
NaCl D.
NH4CI
A,H2S04 B.
NaOH C.
NaCl D.
NH4CI
14、下表是一些酸碱指示剂的变色范围。在常温下,下列熔液中加入甲基橙显黄色,加入石恶显红色的是
|
指示剂 |
pH变色范围 |
酸色 |
碱色 |
|
甲基橙 |
3. 1- 4.4 橙色 |
pH<3.1 红色 |
pH>4 黄色 |
|
石蕊 |
5-8 紫色 |
pH<5.0 红色 |
pH>8.0 蓝色 |
A,pH=2的HCI溶液 B. pH=8的NaOH溶液
C. pH=4. 7的H2S04溶液 D. pH=9的Ba(OH)2溶液
13、下列化学反应的离子方程式书写正确的是
A金属铝溶于NaOH榕液:Al十20H-=== A102-+H2↑
B. NaHC03溶液与过量NaOH溶液反应:H++OH- = H2O
C.单质Cu与稀HN03反应:Cu+2H++2N03- === Cu2+十2NO ↑ + H2O
D.BaCl2溶液与Na2 S04溶液反应:Ba2++SO42- = BaS04↓
12、如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生
的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还
原剂的是( )
A,甲 B,乙 C,丙 D,丁
11、下列离子能影响水的电离平衡且能使水的电离平衡向右移动的是( )
A,Fe2+ B,OH- , C.
H30+  D.Cl-
D.Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com