
I、教师在元素及其化合物复习中通常存在如下问题
(1)缺少对《考试大纲》中的考试范围及要求和历届高考试题元素化合物试题的研究,因而有些教师在复习备课过程中心中无纲,随意性较强,针对性薄弱。
(2)第一轮按教材章节顺序复习过慢,知识点讲解过细,随意拓宽教学复习内容,造成学生在复习中感觉到上新课一样,知识点很多比较零碎不容易掌握。
(3)布置练习的题量过多,难度过高,不加选择的“题海战术”,大量重复的机械训练,使学生感觉到复习练习中重点不突出,学习苦燥无味。
(4)在平时课堂教学中老师的灌输太多,“教”多“学”少,缺乏对学情的了解和研究 ,缺少对学生的学习热情激发,学生感觉没有学习成就感,造成学生学习积极性不高。
(5)教师在复习过程中缺少对教材中前后知识的联系、综合(包括元素化合物中每一章演示实验、学生实验的综合、改进和创新)等,造成学生对综合应用能力比较薄弱。
II、学生在元素及其化合物复习中通常存在如下问题
(1)在复习过程中轻视教科书(书本)的基础作用和导向功能,遇到书本基础记忆相关知识练习中不会做的题目,自己不主动去看书查阅,随意写一个答案了草完成作业。
(2)方程式书写不规范,如化学式字母大小写错误、反应条件没有注明,未配平,沉淀与气体符号漏写,可逆反应未用可逆符号等。另外,化学用语用字错误,包括物质名称错误,例如,“氯化铵”写成“氯化氨”等。
(3)不按要求答题,如名称与符号错写;离子方程式写成了化学方程式;用电子式表示分子组成时仍然用分子式表示等;审题不清,答非所问。
(4)表达能力存在缺陷:非选择题的答题方式主要是填空,虽然答题要求也只是结论性的,但从平时测验和练习的情况看,学生答题不理想,主要原因是表达能力与化学学科的基本素养差,表现为表达错误或不规范,表述不符合化学学科要求等。
(5)自我总结能力比较薄弱,每一单元复习以后,没有有效的把知识形成网络框架图,造成解题时不能有效提取相应知识,不能运用已复习知识来解决具体问题。
了解元素原子核外电子排布的周期性与元素性质递变关系。重点掌握典型金属和典型非金属在周期表中的位置及与其性质的关系。了解其他常见金属和非金属元素的单质及其化合物。该专题知识内容要求共28条,其中按三个层次具体分布如下:了解有20条(略)、理解(掌握)有7条[(1)掌握钠和镁化学性质。(2)从原子的核外电子排布,理解IA、ⅡA族元素(单质、化合物)的相似性和递变性。(3)从原子的核外电子排布,理解卤族元素(单质、化合物)的相似性和递变性。(4)掌握氯气的化学性质。(5)掌握硫酸、硝酸的化学性质。(6)掌握Fe和Al的化学性质。(7)以Fe(Ⅱ)、Fe(Ⅲ)的相互转化为例,理解变价金属元素的氧化还原性]、综合应用有1条[各部分知识的综合应用]。由此可知,元素化合物部分的主干知识:(1)以Na、Mg为代表的ⅠA、ⅡA性质。(2)以N、O、S、Cl为代表的ⅤA、ⅥA、ⅦA性质。 (3)Al、Fe单质及化合物性质。(4)常见物质的制备和常见物质(离子)检验。(5)环保问题。
3.作用部分:
只要表达出题中的意见即可。得分点:(0,1,2…15)
(09全国理综I,T28)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。

⑴接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为______极;
②电极b上发生的电极反应为_________________;
③列式计算电极b上生成的气体在标准状况下的体积:_________
④电极c的质量变化是_________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液_________________________;
乙溶液_________________________;
丙溶液_________________________;
⑵如果电解过程中铜全部析出,此时电解能否继续进行,为什么?___。
[解析]⑴①乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2  2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2 ×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。
2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2 ×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。
⑵铜全部析出,可以继续电解H2SO4,有电解液即可电解。
[答案]⑴①正极 ②4OH--4e-=2H2O + O2↑。③2.8L ④16g ⑤甲增大,因为相当于电解水;乙减小,OH-放电, H+增多。丙不变,相当于电解水。
⑵可以 铜全部析出,可以继续电解H2SO4,有电解液即可电解
28 题评分细则
(1)①“正”或“+”或正极(0,1)其它不给分
②4OH--4e-=2H2O + O2↑ (0,1,2)
反应式书写不规范累计扣1分,如未标气体箭头;e上“-”未写;用→,-表达。配平不是最简式。反应式未配平、化学式书写错误不给分。
③水减少的质量:丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2  2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。
(0,1)
2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。
(0,1)
表达式未带单位不扣分;表达式错误,结果错误,结果无单位均不给分;
生成氧气体积:0.5/4×22.4=2.8L 表达式1分,结果1分。
表达式错误扣2分,结果错误,结果无单位扣1分。
若列总计算式计算,则表达式1分,结果计1分。 (0,1,2)
④16(15.9)(0,1)其他不给分。
⑤甲溶液碱性增大(pH增大),因为电解后,水量减少,溶液中的NaOH浓度增大(0,1,2)
乙溶液酸性增大(pH减小),因为阳极上的OHˉ生成O2,溶液中 的浓度增加(0,1,2)
以上只说那个也碱性变化或酸性变化不给分。
丙溶液酸性大小没有变化(pH不变),因为K2SO4是强酸强碱盐。浓度增加不影响溶液酸碱性。(0,1,2)
(判断错误,无论如何解释都不给分);判断不正确,但解释给出了明确变化趋势之
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应。(0,1,2)
判断正确1分,解释只要说出其中一点均给1分。给出原则为分段给分。
(电解H2SO4溶液给1分。电解CuSO4不给分)
(09全国理综I,T29)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
⑴W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_________________;
⑵Q的具有相同化合价且可以相互转变的氧化物是_________;
⑶R和Y形成的二价化合物中,R呈现最高化合价的化合物是化学式是__;
⑷这5个元素的氢化物分子中,
①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)__,其原因是___
②电子总数相同的氢化物的化学式和立体结构分别是________;
⑸W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是______________________
[解析]本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。⑴SiO2为原子晶体。⑵高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。⑶Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。Y为O,所以R的最高价化合物应为SO3。⑷显然D为P元素。①氢化物沸点顺序为NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O的电子数均为10,结构分别为三角锥和V形,SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。⑸由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
[答案]⑴原子晶体。⑵NO2和N2O4⑶SO3。(⑷①NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O分别为三角锥和V形;SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。⑸SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
29题评分细则
(1) 正确答案:原子晶体 其他答案均错。 得分点(0,2)
(2) 正确答案:NO2和N2O4;NO2(N2O4)
或中文名称:二氧化氮和四氧化二氮; 答对一个给一个。
得分点:(0,1,2)
(3) 正确答案:As2S5,必须是化学式。得分点:(0,2)
(4) ①正确答案:NH3 AsH3 PH3
化学式及顺序必须同时正确--得2分,否则0分。
原因:NH3分子间存在氢键,所以沸点最高--得1分;
相对分子质量(分子质量、分子量)AsH3大于PH3,分子间作用力(范德华力)AsH3大于PH3,故AsH3沸点高于PH3--得1分。
沸点随相对分子质量(分子质量、分子量)的增大而升高--得1分。
得分点(0,1,2,3,4)
②SiH4正四面体--得1分;
PH3三角锥(三棱锥)--得1分;
H2S角形(V形,V字形)--得1分;
得分点(0,1,2,3)
立体结构画成图表示的,正确的给分。
(5) 正确答案:
SiCl4+4NH3=Si(NH2)4+4HCl
3 Si(NH2)4= Si3N4+8NH3↑
每个方程1分,方程式必须配平。不配平的0分。
方程式中无反应条件的(加热符号和高温)的0分。
方程式中不写等号的,0分。
NH3后面无箭头的,不扣分。
得分点(0,1,2)
(09全国理综I,T30)化合物H是一种香料,存在于金橘中,可用如下路线合成:


已知:
回答下列问题:
⑴11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H2O。
A的分子式是________________
⑵B和C均为一氯代烃,它们的名称(系统命名)分别为________;
⑶在催化剂存在下1 mol F与2 mol H2反应,生成3-苯基-1-丙醇。F的结构简式是___
⑷反应①的反应类型是__________________;
⑸反应②的化学方程式为__________________
⑹写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式:
[解析]⑴88gCO2为2mol,45gH2O为2.5mol,标准11.2L,即为0.5mol,所以烃A中含碳原子为4,H原子数为10,则化学式为C4H10。⑵C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照取代时有两种产物,且在NaOH醇溶液作用下的产物只有一种,则只能是异丁烷。取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷。⑶F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键。从生成的产物3-苯基-1-丙醇分析,F的结构简式为  。⑷反应①为卤代烃在醇溶液中的消去反应。⑸F被新制的Cu(OH)2氧化成羧酸,D至E为然后与信息相同的条件,则类比可不难得出E的结构为
。⑷反应①为卤代烃在醇溶液中的消去反应。⑸F被新制的Cu(OH)2氧化成羧酸,D至E为然后与信息相同的条件,则类比可不难得出E的结构为 。E与G在浓硫酸作用下可以发生酯化反应。⑹G中含有官能团有碳碳双键和羧基,可以将官能团作相应的位置变换而得出其芳香类的同分异构体。
。E与G在浓硫酸作用下可以发生酯化反应。⑹G中含有官能团有碳碳双键和羧基,可以将官能团作相应的位置变换而得出其芳香类的同分异构体。
[答案]⑴C4H10。⑵2-甲基-1-氯丙烷、2-甲基-2-氯丙烷⑶ ⑷消去反应。
⑷消去反应。
⑸

⑹ 、
、 、
、 、
、
30题评分标准以国家标准答案为原则,补充如下细则:
(1) C4H10分子式正确2分,写成物质名称或结构式不得分。名称及结构式加写且正确则给分。
(2) 写出2-甲基-1-氯丙烷和2-甲基-2-氯丙烷(或1-氯-2-甲基丙烷和2-氯-2-甲基丙烷)二者其一得一分,两个均正确得2分。三个以上错一个扣一分知道本题为零分。正丁醇 的无分;
(3) 写出正确结构式得2分。
(4) 写“消除反应”“消除”“消去”均得分,写其他文字不得分。1分
(5) “→”写成“≒”,“浓H2SO4”写成“浓硫酸”不扣分.3分
反应条件不完整或不规范。“→”写成“=”,无“浓”字。无“△”,把“H2SO4”写成其他酸或“H+”统一扣一分。缺少反应物生成物以及结构式有错误不得分。
(6)每个结构式正确得一分,四个全正确得5分。在四个结构式全对的基础上有多写的得4分
另外,有机物的结构式书写必须规范。如,“C”写成“O封口”“H”写成“h”“醛基”写成“羟基形式”等都算错误。
T30前四问主要错误小析:
(1) 有写成“C4H5”或“C2H5”的,应该是计算中没注意到“nH2O”与“nH”的区别及实验式与分子式的区别。还有许多C8H10及C4H1O的,也有写成结构式的。
(2) 写直链结构的较多,应该是分析题意不清晰导致的。第二种情况则是命名的问题。(这似乎是一个教学盲点),主要有分隔号与连接号不清楚。使用出现错误。如:2,甲基,氯一丙烷。
(3) 的主要错误有a.苯环写错。b.双链上氢的个数出错。如-C=CH2- c.醛基的写法出错。如CHO-等。
(4) 的错误较少。主要是一些“脱水”“脱去”“消化”“硝去”“销去”等。有写“加成”“取代”“氧化--还原”等,应该是做不到而企图能碰分的吧。不过要注意的是有许多是写“消去”的。这次得了分,下一次不一定有此好事的!
另外本题中有较多涂改现象,主要是原来的理综试题中T30是生物题。而部分考生先做生物的又不看题号,填写在本题中发生了错误之后,再装紧涂改的不知道这部分的考生是不是很郁闷。
得分情况
前四小题共7分,而平均分仅大约2.79分。得了3·5分的较多。具体得分分布如下:(大约值)
0分:20.82% 1分:10.80% 2分:5.52% 3分:30.41% 4分:1.58% 5分27.70% 6分0.59% 7分:2.42%
2.试剂部分:化合物分子式或物质名称错误不给分。
①C,浓H2SO4和C。(浓硫酸、木炭等)。少“浓”或缺物质.错字均不给分。
②B,无水CuSO4(硫酸铜),变色硅胶,无水氯化钴均不给分,缺“无水”不给分。“无水CuSO4晶体”给分,变色硅胶中无“变色”不给分。
① A KMnO4溶液,酸性KMnO4溶液,K2Cr2O7溶液,Na2Cr2O7溶液 品红溶液均给分。KMnO4 “不给分”,品红“不给分”
② A(几乎同上),但用品红溶液不给分。
③ A澄清石灰水,Ba(OH)2溶液均可。无“澄清”不给分,也可写Ca(OH)2溶液。
1.仪器部分|:如果C不在首先,该大题得0分;
如果B不在第2行,则该行得0分;其余3行检出顺序正确,分行给分。
如果CO得检出在第2行,从该行起一下均不给分,包括仪器。(H2O、CO2、SO2 均不能检出)。
在仪器连接顺序正确(CBAAA)的前题下,各项分段给分,仪器、试剂、作用各1分。
如果新增步骤或漏掉,合并步骤,其不影响物质检出,不扣分,若影响了物质的检验,及该行一下均不给分。
如果仪器连接顺序正确CBAAA,而无试剂及作用或试剂作用均错,给5分。
29.材料一
新中国成立60年来,特别是改革开放以来,在党中央的亲切关怀和全国人民的大力支持下,自治区党委、人民政府带领各族干部群众团结奋斗、顽强拼搏,新疆经济社会发展取得了举世瞩目的辉煌成就。2008年,新疆生产总值达到4 203亿元,比新疆维吾尔自治区成立(1955年)前的1952年增长了86.4倍,比1978年增长19. 6倍; 城镇居民人均可支配收入达到11 432元,农村居民人均纯收入达到3503元,分别比1978年增长35倍和28倍。扶贫攻坚、抗震安居、防病改水、牧民定居、免费义务教育等一系列重大民生工程的实施,使新疆各族人民广泛享受到改革发展的成果,生活水平显著提高。在党和国家民族政策的光辉照耀下,少数民族各项事业迅猛发展、欣欣向荣,少数民族的政治地位空前提高。
材料二
2009年9月3日,外交部发言人姜瑜在例行记者会表示,任何国家的政府都不会无视暴力活动的发生。中国政府依法处理“7·5”事件,依法保护各族人民的生命财产安全,维护社会稳定、民族团结、国家统一,这是正义之举,是中国的内政。任何外国和组织都无权干涉中国的内政。
(1)料一,运用政治常识知识,说明新疆取得辉煌成就的原因。(6分)
(2)料二,运用我国外交政策,谈谈你对我国政府依法处理"7 • 5"事件立场的认识。(6分)
28.大学生和农民工的就业问题成为今年两会代表委员关注的焦点,也成为当前政府解决就业问题的重中之重,从经济常识角度简要分析国家高度重视解决大学生和农民工就业问题的原因。(12分)
27. 实现从传统农业到现代农业的转变,是促进农业稳定发展和农民持续增收的有效途径。推进农业现代化,千方百计促进农民收入持续增长,国家采取了一系列政策。运用所学经济学知识分析下面案例中王某家庭收入增长的原因(12分)
|
案例 |
分析 |
|
(1)京郊农民王某承包了本村农民转包的100亩土地种植稻谷。家庭纯收入突破16万元 |
|
|
(2)王某在购买农业机械和种子时,获得国家补贴,此两项共节约成本6000余元。 |
|
|
(3)由于国家扩大了粮食储备,并采取措施防止粮食过度进口冲击国内市场,使得王某生产的稻谷顺利售出去。 |
|
|
(4)王某的妻子和儿子分别在本村的旅游公司和建筑公司上班。年收入计8万元左右。 |
|
26.材料一 中小企业在一些国家企业总数中的比重、贡献率,就业人数情况
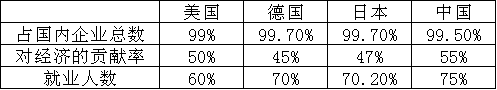
注:美国70%的创新发明是在小企业实现的
材料二 温家宝在广东调研时指出,2008年下半年以来,国际经济形势急剧恶化,我国企业特别是中小企业受到的冲击越来越大,生产经营困难,(生产成本升高、融资困难加剧、外贸出口受阻)各级政府要努力解决中小企业发展中的问题,促进中小企业又好又快的发展。
材料三 2009年9月19日,国务院发布关于进一步促进中小企业发展的若干意见,提出了进一步促进中小企业发展的八方面举措。(18分)
(1) 材料一说明了什么?(4分)
(2) 用经济常识知识,从政府与企业两个角度说明怎样做才能使我国中小企业摆脱困难,实现又好又快发展?(10分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com