
22.有BaCl2和NaCl的混合溶液w L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗a mol H2SO4、b mol AgNO3。据此得知原混合溶液中的c(Na+) mol/L为
A.(b-2a)/w B.(b-a)/w C.(2b-2a)/w D.(2b-4a)/w
第Ⅱ卷(非选择题,共84分)
21.工业生产苯乙烯是利用乙苯的脱氢反应:
|
|

针对上述反应,在其它条件不变时,下列说法正确的是
A.加入适当催化剂,可以提高苯乙烯的产量
B.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
C.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
D.加入乙苯至反应达到平衡过程中,混合气体的平均相对分子质量不断增大
20.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3  3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2  7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是
A.C3N3(OH)3与HNCO为同一物质
B.反应中NO2是还原剂,HNCO是氧化剂
C.6mol NO2在反应中转移电子24mol
D.CO2是氧化产物,N2既是氧化产物又是还原产物
19.某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8电子稳定结构。下列关于该化合物的说法不正确的是
 A.化学式是Al2Cl6
A.化学式是Al2Cl6
B.不存在离子键和非极性共价键
C.在固态时所形成的晶体是分子晶体
D.是离子化合物,在熔融状态下能导电
18.下列说法不正确的是
A.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸和乙醇
B.电解精炼铜时,相同时间内阳极溶解铜的质量比阴极析出铜的质量小
C.将溴乙烷与NaOH溶液共热后冷却,再滴加硝酸银溶液检验水解产物中的溴离子
D.硫酸工业中,在接触室安装热交换器是为预热反应气体,达到适宜的反应温度
17.温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤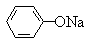 、⑥CH3COONa溶液的pH由小到大的顺序是
、⑥CH3COONa溶液的pH由小到大的顺序是
A.③①④②⑥⑤ B.①③⑥④②⑤
C.③②①⑥④⑤ D.⑤⑥②④①③
16.下列说法或表示正确的是
A.等质量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
B.C(石墨)→C(金刚石);ΔH=+1.19 kJ· mol-1,所以金刚石比石墨稳定
C.在101kPa,1mol物质完全燃烧生成稳定氧化物时所放出的热量叫该物质的燃烧热
D.在101 kPa下,2g H2完全燃烧生成液态水放出285.8 kJ热量,其热化学方程式为
2H2(g)+O2(g)= 2H2O(l);ΔH=-285.8 kJ· mol-1
15.某晶体由两种阳离子、一种阴离子和结晶水组成,取少量该晶体进行如下实验:
①将晶体置于试管中加热,试管口有无色液体生成;
②待试管冷却后加水,固体全部溶解;
③向试管中逐滴加入Ba(OH)2溶液至过量,同时加热,生成沉淀的量先增多后减少,最终仍有沉淀未溶解,此过程中有刺激性气味气体生成。
根据以上实验现象判断,该晶体是
A.NH4Al(SO4)2·12H2O B.KAl(SO4)2·12H2O
C.(NH4)2Fe(SO4)2·6H2O D.KCl·MgCl2·6H2O
14.已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如下图所示,下列说法正确的是
 A.Z元素的原子半径可能比Y元素的小
A.Z元素的原子半径可能比Y元素的小
B.Z元素的最高化合价可能比Y元素的高
C.W的气态氢化物的稳定性一定比Y的强
D.Z的最高价氧化物的水化物的酸性一定比W的强
13.下列各组离子能在指定溶液中,不能大量共存的是
A.无色溶液中Na+、Mg2+、NO3-、Cl-
B.使石蕊变红的溶液中Fe3+、NO3-、Na+、SO42-
C.加入Mg能放出H2的溶液中NH4+、Cl-、K+、SO42-
D.水电离的c(H+)=10-12mol/L的溶液中Na+、Fe2+、Cl-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com