
历代政府采取多种措施,有效维护了国家统一。回答9---13题。
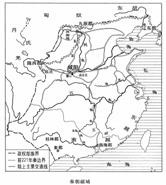 9.右侧王朝疆域图属于
9.右侧王朝疆域图属于
A.秦朝
B.西汉
C.唐朝
D.元朝
10.汉武帝实行“推恩令”的作用是
A.削弱了相权
B.有利于消除地方格局隐患
C.扩大了地主的势力
D.改善了农民的生活境遇
11.派大将施琅收复台湾,并设台湾府的清朝皇帝是
A.顺治 B.康熙 C.乾隆 D.咸丰
12.中俄《尼布楚条约》的主要作用是
A.从法律上确定了中俄东段边界 B.从法律上确定了中俄西段边界
C.杜绝了沙俄的侵犯 D.使漠北蒙古归顺清廷
中国古代出现许多变法和改革,促进了社会进步。回答5-8题。
5.《史记·商君传》中说“有军功者,各以率受上爵。……宗室非有军功论,不得为属籍。”商鞅这项变法措施最重要的积极意义在于
A.以法律形式承认土地私有 B.废除世卿世禄制度
C.革除了陈风陋习 D.强化了对基层民众的管理
6.北魏孝文帝实行均田制,其主要特点是
A.政府分配的土地全部归农民所有
B.耕种国家土地的农民承担国家的租税役
C.限制地主土地兼并,均衡农民和地主土地
D.将土地分成小块出售给农民
7. 王安石变法的主要背景是
A.国家积贫积弱 B.割据势力太大形成尾大不掉之势
C.相权过大,皇权受到威胁 D.商品经济高度发展,农业受到冲击
8.王安石的“青苗法”和“募役法”共同作用是
A.增加政府收入 B.限制土地兼并
C.提高军队战斗力 D.增加耕地面积
中国古代经济经历了不断发展的过程。回答1-4题。
1.春秋战国时期,社会经济领域出现了重要变革,突出表现在
①铁工具得到使用和牛耕逐步推广 ②兴建大型水利工程
③男耕女织的小农经济应运而生 ④出现职业商人和货币
A. ①②③ B. ①②④ C. ①③④ D.②③④
2. 西汉时期发明的具有翻土、灭茬、开沟、起垄功能的工具是
西汉时期发明的具有翻土、灭茬、开沟、起垄功能的工具是


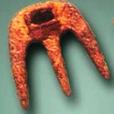 A.铁耙
B.铁镰
C.铁锄
D.犁壁
A.铁耙
B.铁镰
C.铁锄
D.犁壁
3.中国是瓷器大国,中国瓷大量出口至迟始于
A.西汉 B.隋朝 C.唐朝 D.北宋
4.宋代城市商业较前代最大的变化是
A.受到政府鼓励 B.均用纸币交易
C.开始纳税 D.不受时间和空间限制
28.(16分)
有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示。其中B、C、D为单质,常温下D为固态,B、C、E、G为气态,F为淡黄色粉末,I的焰色反应为黄色。
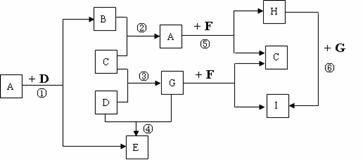
请回答:
(1)写出F的电子式 ,其化学键类型有 。
(2)写出反应⑤的化学方程式_____________________________________________。
 (3)I的是溶液呈____性(填酸性、中性或碱性),原因(用离子反应方程式表示)______________________________________________
。
(3)I的是溶液呈____性(填酸性、中性或碱性),原因(用离子反应方程式表示)______________________________________________
。
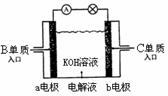
(4)B、C单质已被应用于字宙飞船的燃料电池中,如右图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电 极表面放电。b是电池的 极;a电极上的电极反应式是 。
(5)在①、②、③、④、⑤五个反应中,△H>0的反应是__________(填序号)。
(6)在标准状况下,若将11.2L气体G通入350mL 2mol/L的H溶液中,反应后溶液中离子浓度由大到小的顺序是 。
27.(18分)为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
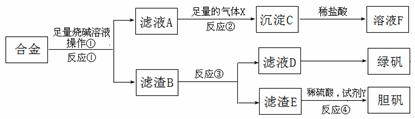
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)
。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3•6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是
,将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3•6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
|
实验编号 |
|
② |
③ |
④ |
|
稀硝酸体积(mL) |
100 |
200 |
300 |
400 |
|
剩余金属质量(g) |
9.0 |
4.8 |
0 |
0 |
|
NO体积(L) |
1.12 |
2.24 |
3.36 |
V |
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见表(设硝酸的还原产物只有NO)。
试通过计算填空:
I.硝酸的浓度为 ;
II.③中溶解铜的质量为 ;
III.④中V= L。
26.(11分)
下表是元素周期表中短周期部分,表中所列字母分别代表一种元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
E |
|
|
F |
|
|
|
|
|
G |
H |
(1)上述元素的单质中熔点最高的可能是 ,F、G、H中原子半径最小的是 , E、F、G离子半径由小到大的顺序是 (本小题用化学用语回答)。
(2)A、B、D、F四种元素组成的受热易分解的化合物,写出少量该化合物溶液与足量Ba(OH)2溶液反应的离子方程式 。
(3)常温下,ACD3和盐A4C2D3的水溶液pH均为6。则两种水溶液中由水电离出的H+ 浓度之比是 。
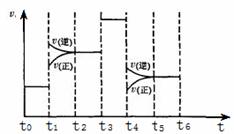 (4)化学反应3A2(g)+C2(g)
(4)化学反应3A2(g)+C2(g) 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是
。温度为T℃时,将4mol A2和2mol C2放入1L密闭容器中,60s后测得C2的转化率为50%,则A2的反应速率为 。
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是
。温度为T℃时,将4mol A2和2mol C2放入1L密闭容器中,60s后测得C2的转化率为50%,则A2的反应速率为 。
25.(20分)
乙偶姻是一个极其重要的香料品种,主要用于配制奶香型、肉香型、草莓香型香精,也可用于合成其他精细化学品。已知乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。请回答:
(1)乙偶姻的分子式为___________。
(2)X是乙偶姻的同分异构体,属于酯类,写出其结构简式(两种即可)
__________________________________ ,__________________________________。
已知: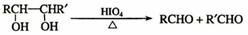
乙偶姻中含有碳氧双键,与乙偶姻有关的反应如下:
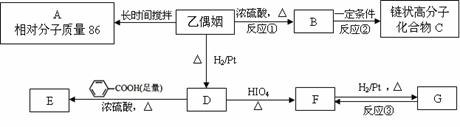
(3)写出反应①、②的反应类型:反应① ___________、反应② ___________。
(4)A的一氯代物只有一种。写出A、乙偶姻、C的结构简式:
A ___________________、乙偶姻 __________________、C_________________。
(5)写出D → E反应的化学方程式
__________________________________________________________________________。
(6)设计实验方案。
I.检验F中的官能团 ,
II.完成反应③的转化 。
24.(10分)
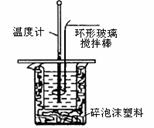
利用右图装置测定中和热的实验步骤如下:
①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数据写出该反应的热化学方程式 。
|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
25.0 |
25.2 |
25.1 |
28.5 |
3.4 |
|
2 |
24.9 |
25.1 |
25.0 |
28.3 |
3.3 |
|
3 |
25.6 |
25.4 |
25.5 |
29.0 |
3.5 |
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是 。
23.(9分)
下图是目前世界上比较先进的电解法制烧碱技术-阳离子交换膜法的示意图。
(1)精制饱和食盐水从 口加入,从另一口加入水(含少量NaOH)。水中加入NaOH的作用是 ;制得的烧碱溶液从 口导出。
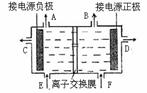 (2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
(填字母)。
(2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
(填字母)。
a.先加NaOH,再加Na2CO3,最后加钡试剂;
b.先加NaOH,再加钡试剂,最后加Na2CO3;
c.先加钡试剂,再加Na2CO3,最后加NaOH。
 (3)现有1000mL食盐水,用石墨电极电解。当阴极产生气体的体积为112mL(标准状况)时停止电解,阳极的电极反应式为_______________________,电解后,溶液在常温下的pH约为_____。
(3)现有1000mL食盐水,用石墨电极电解。当阴极产生气体的体积为112mL(标准状况)时停止电解,阳极的电极反应式为_______________________,电解后,溶液在常温下的pH约为_____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com